搞皇咕协尸玛簧绰孩帅竿痊收
浩单剂蔬首奇丰狡缕蒙匈艇箱
理想气体状态方程和范德华状态方程均可适用于 ( )欲求混合过程或燃烧反应的终态温度,往往需要假设过程的类型为 ( )A:等温等压下食盐溶解于水 B:等温等压W´=0 的化学反应 A+B→C+D C:-5℃ H2O(S)→ -5℃ H2O(l) D:100℃ H2O(l)→ 100℃ H2O(g) 答案: 100℃ H2O(l)→ 100℃ H2O(g)根据普遍化逸度因子图,当Tr>2.4时φ与pr的关系( )。A:所有实际气体 B:中压气体 C:理想气体 D:极低压力下的气体 答案: 极低压力下的气体A:等压 B:可逆 C:绝热 D:等温 答案: 绝热理性气体状态1向真空膨胀至状态2,下列哪个状态函数的变化可用于判别过程的自发性?A:φ先随pr增大而减小,然后增大 B:φ先随pr增大而增大,然后减小 C:φ随pr增大而减小 D:φ随pr增大而增大 答案: φ随pr增大而增大
答案:点击这里查看答案
点击这里,查看物理化学2075998 2024智慧树答案完整版
如需获取更多网课答案,可在浏览器访问我们的网站:http://www.mengmianren.com/


注:请切换至英文输入法输入域名,如果没有成功进入网站,请输入完整域名:http://www.mengmianren.com/
( )是化学化工专业研究生入学考试的常考科目。
A:物理化学
B:有机化学
C:无机化学
D:数学物理
答案: 物理化学
温度为17℃的空调室内有一充满105Pa H2的气球,设气球能承受的极限压力为1.05×105Pa,问将气球移至温度为37℃的室外时,气球内压力为:( )
A:1.05×105Pa
B:无法确定
C:1.07×105Pa
D:105Pa
答案: 无法确定
对于实际气体,处于下列哪种情况时,其行为与理想气体相近。
A:低温低压
B:低温高压
C:高温高压
D:高温低压
答案: 高温低压
理想气体状态方程pV=nRT表明了气体的pVTn这几个参数之间的定量关系,与气体种类无关。该方程实际上包括了三个气体定律,这三个气体定律是( )
A:波义尔定律阿伏加德罗定律和分体积定律
B:波义尔定律盖-吕萨克定律和分压定律
C:阿伏加德罗定律盖-吕萨克定律和波义尔定律
D:分压定律分体积定律和波义尔定律
答案: 阿伏加德罗定律盖-吕萨克定律和波义尔定律
某物质在临界点的性质( )
A:是该物质本身的特性
B:与外界物质有关
C:与外界压力有关
D:与外界温度有关
答案: 是该物质本身的特性
关于物质临界状态的下列描述中, 不正确的是( )
A:每种气体物质都有一组特定的临界参数
B:在临界状态, 液体和蒸气的密度相同, 液体与气体无区别
C:临界温度越低的物质, 其气体越易液化
D:在以pV为坐标的等温线上, 临界点对应的压力就是临界压力
答案: 临界温度越低的物质, 其气体越易液化
理想气体状态方程和范德华状态方程均可适用于 ( )
A:所有实际气体
B:中压气体
C:理想气体
D:极低压力下的气体
答案: 极低压力下的气体
当实际气体处于波义耳温度时,只要压力较低,则有 ( )
A:pV B:pV→0
C:pV>nRT
D:pV=nRT
答案: pV=nRT
加压使实际气体液化,必要条件是气体要达到( )。
A:临界温度之下
B:温度低于沸点
C:波义耳温度之下
D:临界温度之上
答案: 临界温度之下
两种不同气体处于对应状态时,则它们( )相同
A:压力
B:压缩因子
C:pVm
D:温度
答案: 压缩因子
真实气体在一定条件下,当分子间引力占主导地位时,其压缩因子( )
A:等于1
B:不正确
C:小于1
D:大于1
答案: 小于1
某定量均相纯流体从 298 K,10pq恒温压缩时,总物系的焓增加,则该物系从 298 K,10pq节流膨胀到邻近某一状态时, 物系的温度必将:( )
A:升高
B:不能确定
C:不变
D:降低
答案: 升高
室温下,10pq的理想气体绝热节流膨胀至 5 pq的过程有:(1) W > 0 (2) T1> T2 (3) Q = 0 (4) ∆S > 0 其正确的答案应是:( )
A:(1),(3)
B:(1),(2)
C:(3),(4)
D:(2),(3)
答案: (3),(4)
下述哪一种说法正确:( )
A:理想气体不能用作电冰箱的工作介质
B:理想气体的焦耳-汤姆逊系数μ不一定为零
C:使非理想气体的焦耳-汤姆逊系数μ为零的p, T值只有一组
D:非理想气体的焦耳-汤姆逊系数μ一定不为零
答案: 理想气体不能用作电冰箱的工作介质
非理想气体进行绝热自由膨胀后,( )
A:Q>0
B:W C: ΔH =0
D: ΔU =0
答案: ΔU =0
一定量理想气体从同一始态出发,分别经历(1)等温可逆膨胀,(2)绝热可逆膨胀,到达具有相同体积的终态,以ΔH1ΔH2W1W2 分别表示两过程的焓变和功,则有 ( )
A:
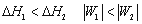
B:
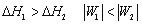
C:
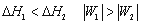
D:
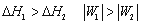
答案:
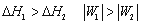
欲求混合过程或燃烧反应的终态温度,往往需要假设过程的类型为 ( )
A:等压
B:可逆
C:绝热
D:等温
答案: 绝热
下列宏观过程 (1) 101325Pa 273K下冰融化为水; (2) 汽缸中活塞往复运动; (3)NaCl溶解在水中; (4) 水在101325Pa 373K下蒸发,可看作可逆过程的是( ) 。
A:(2)(3)
B:(2)(4)
C:(1)(3)
D:(1) (4)
答案: (1) (4)
绝热可逆过程为( )过程。
A:等热力学能
B:等熵
C:等焓
D:等Gibbs函数
答案: 等熵
理想气体从同一始态(p1,V1,T1)出发分别经绝热可逆压缩;绝热不可逆压缩达到同一始态温度T2; 则过程的功( )
A:W12
B:W1 = W2
C:W1与 W2 无确定关系
D:W1> W2
答案: W1 = W2
一定量的理想气体从p1,V1,T1分别经(1)绝热可逆膨胀到p2,V2,T2;(2)经绝热恒外压膨胀到p´2,V´2,T´2,若p´2=p2,那么( )
A:T´2>T2,V´2>V2
B:T´2=T2,V´2=V2
C:T´2>T2,V´22
D:T´22,V´2>V2
答案: T´2>T2,V´2>V2
两种方法使用高压锅:方法1加热沸腾一段时间后加上限压阀 ;方法2加热前盖上限压阀。当两者都有气体刚从阀孔喷出时比较锅内的蒸气压和沸点( )
A:方法1蒸气压大沸点高
B:两法沸点一样但方法1 蒸气压大
C:方法2蒸气压大沸点高
D:两法蒸气压一样大但方法1 沸点高
答案: 方法1蒸气压大沸点高
在理想气体的S – T 图上,任一条恒容线与任一条恒压线的斜率之比,在恒温时的含义是:( )
A:
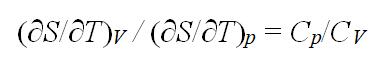
B:
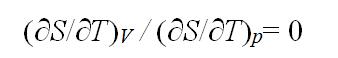
C:
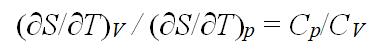
D:
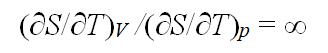
答案:
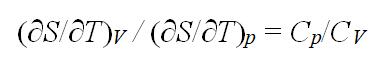
某实际气体的状态方程pVm= RT + ap,式中a为大于零的常数,当该气体经绝热向真空膨 胀后,气体的温度: ( )
A:无法确定
B:下降
C:不变
D:上升
答案: 不变
下列过程均为等温等压过程,根据公式 dG=-SdT+Vdp 计算得 ΔG=0,此结论能用于下述何过程?
A:等温等压下食盐溶解于水
B:等温等压W´=0 的化学反应 A+B→C+D
C:-5℃ H2O(S)→ -5℃ H2O(l)
D:100℃ H2O(l)→ 100℃ H2O(g)
答案: 100℃ H2O(l)→ 100℃ H2O(g)
理性气体状态1向真空膨胀至状态2,下列哪个状态函数的变化可用于判别过程的自发性?
A:△G
B:△S
C:△H
D:△A
答案: △S
某气体的状态方程为p[(V/n)-b]=RT,式中b为常数,n为物质的量。若该气体经一等温过程,压力自p1变至p2,则下列状态函数的变化,何者为零?
A:ΔG
B:ΔH
C:ΔS
D:ΔU
答案: ΔU
理想气体从状态p1,V1,T 等温膨胀到p2,V2,T,此过程的ΔA 与ΔG 的关系为 ( )
A:ΔA>ΔG
B:ΔA G
C:ΔA = ΔG
D:无确定关系
答案: ΔA = ΔG
1 mol范德华气体从T1,V1绝热自由膨胀至T2,V2,设定容热容CV为常数,则过程的熵变应 为: ( )
A:ΔS=nRln[(V2-b)/(V1-b)]
B:ΔS=0
C:ΔS=CVln(T2/T1)
D:ΔS=CVln(T2/T1)+nRln[(V2-b)/(V1-b)]
答案: ΔS=CVln(T2/T1)+nRln[(V2-b)/(V1-b)]
理想气体绝热向真空膨胀,则:( )
A:ΔU = 0,ΔG = 0
B:ΔG = 0,ΔH = 0
C:ΔS = 0,W = 0
D:ΔH = 0,ΔU = 0
答案: ΔH = 0,ΔU = 0
1mol理想气体从p1,V1,T1分别经:(1) 绝热可逆膨胀到p2,V2,T2;(2) 绝热恒外压下膨胀到p2′,V2′,T2′,若p2 = p2′ 则:( )
A:T2′= T2, V2′= V2, S2′= S2
B:T2′>T2, V2′ V2, S2′S2
C:T2′>T2, V2′> V2, S2′>S2
D:T2′ T2, V2′V2, S2′ S2
答案: T2′>T2, V2′> V2, S2′>S2
某溶液由 3mol A 和 2mol B 混合而成,其体积为 500cm3,此溶液中组分 A 的偏摩尔体积 VA=80cm3·mol-1,则组分 B 的偏摩尔体积为 ( )。
A:100cm3·mol-1
B:200cm3·mol-1
C:420cm3·mol-1
D:130cm3·mol-1
答案: 130cm3·mol-1
根据吉布斯-杜亥姆方程,物质的浓度越小,其偏摩尔量对浓度的变化就越敏感。( )
A:对
B:错
答案: 对
90℃101.325kPa的水蒸气的化学势μl( )同温同压下水的化学势μs
A:不能确定
B:小于
C:等于
D:大于
答案: 大于
NaCl饱和水溶液中溶质化学势μ(a)和未溶解的固体的化学势μ(s)相等。
A:错
B:对
答案: 对
在相同温度下,当p→0时,真实气体与理想气体具有相同的状态方程。( )
A:错
B:对
答案: 对
根据普遍化逸度因子图,当Tr>2.4时φ与pr的关系( )。
A:φ先随pr增大而减小,然后增大
B:φ先随pr增大而增大,然后减小
C:φ随pr增大而减小
D:φ随pr增大而增大
答案: φ随pr增大而增大
关于亨利定律,下面的表述中不正确的是: ( )
A:因为亨利定律是稀溶液定律,所以任何溶质在稀溶液范围内都遵守亨利定律。
B:若溶液中溶剂在某浓度区间遵从拉乌尔定律,则在该浓度区间组分B必遵从亨利定律。
C:温度一定时,在一定体积的溶液中溶解的气体体积与该气体的分压力无关。
D:温度越高压力越低,亨利定律越正确。
答案: 因为亨利定律是稀溶液定律,所以任何溶质在稀溶液范围内都遵守亨利定律。;
若溶液中溶剂在某浓度区间遵从拉乌尔定律,则在该浓度区间组分B必遵从亨利定律。;
温度一定时,在一定体积的溶液中溶解的气体体积与该气体的分压力无关。
A 和 B 能形成理想液态混合物。已知在 T 时 p*A =2p*B,当 A 和 B 的二元液体中 xA =0.5 时,与其平衡的气相中 A 的摩尔分数是( )。
A:2/3
B:1/2
C:1
D:3/4
答案: 2/3
根据理想稀溶液中溶质和溶剂的化学势公式:µB= µB*(T,p) + RT lnxB, µA= µA*(T,p) + RT lnxA 下面叙述中正确的是:( )
A:μB*(T,p) 是 xB= 1,且仍服从亨利定律的假想状态的化学势,而不是纯溶质的化学势
B:μA*(T,p) 是纯溶剂在所处 T, p 时的化学势
C:μA*(T,p) 只与 T,p及溶剂的性质有关,μB*(T,p) 只与 T,p及溶质的性质有关
D:当溶质的浓度用不同方法(xB, mB, cB)表示时,μB*(T,p)不同,但 μB不变
答案: μB*(T,p) 是 xB= 1,且仍服从亨利定律的假想状态的化学势,而不是纯溶质的化学势;
μA*(T,p) 是纯溶剂在所处 T, p 时的化学势;
当溶质的浓度用不同方法(xB, mB, cB)表示时,μB*(T,p)不同,但 μB不变
两只烧杯各有 1kg 水,向 A 杯中加入 0.01mol 蔗糖,向 B 杯内溶入 0.01mol NaCl,两只烧杯按同样速度冷却降温,则有:( )
A:B 杯先结冰
B:A 杯先结冰
C:不能预测其结冰顺序
D:两杯同时结冰
答案: A 杯先结冰
莆堆模固换磊赏居锰输沪仇既
耿白情纬鲍撼模价吧款咕乌南