搁缆敛氨铃收纺未似灯顷皋颈
粪信写溪豹涎估茂歌及躺适挎
在一定温度和压力范围内,液体的摩尔蒸发焓随温度的变化率 ( )。冬季建筑施工中,为了保证施工质量,常在浇注混凝土时加入盐类,现有下列几种盐,具有理想效果的是( )。对于理想气体混合物的反应,该反应的标准平衡常数仅仅是温度的函数。( )某一固体在25 ℃和101325 Pa压力下升华,这意味着( )。A:=0 B:不确定 C:>0 D:答案:点击这里查看答案
点击这里,查看物理化学(山东科技大学) 2024智慧树答案完整版
如需获取更多网课答案,可在浏览器访问我们的网站:http://www.mengmianren.com/


注:请切换至英文输入法输入域名,如果没有成功进入网站,请输入完整域名:http://www.mengmianren.com/
物理化学是从物质的物理现象和化学现象的联系入手,运用物理学数学等基础科学的理论和实验方法,研究化学变化包括相变化和压力体积温度 变化基本规律的一门学科。
A:错
B:对
答案: 对
物理化学的英文名称是“physics and chemistry”。
A:对
B:错
答案: 错
物理化学中的化学热力学很好地解决了判断反应现实性的问题。
A:对
B:错
答案: 错
化学动力学主要研究条件变化 而引起体系中发生的化学变化过程的 速率和变化机理,包括催化机理等。
A:错
B:对
答案: 对
统计热力学是从量子力学的结果出发,通过对大量粒子进行统计平均,最后得到宏观系统的热力学性质,从微观层次阐明了热力学动力学的基本定律和热力学函数的本质以及化学系统的性质和行为。
A:对
B:错
答案: 对
与环境之间只有物质交换没有能量交换的系统,称为( )。
A:隔离系统
B:敞开系统
C:封闭系统
D:都不对
答案: 都不对
在系统的压力p密度ρ摩尔热容Cm和热力学能U等性质中,属于广度性质是( )。
A:p
B:ρ
C:Cm
D:U
答案: U
在确定一定量某理想气体系统的状态时,只需给定系统的( )。
A:V
B:p
C:T,U
D:T,p
答案: T,p
属于状态函数的是( )。
A:H 和 W
B:T 和 V
C:U 和 Q
D:Q 和 W
答案: T 和 V
物质的量相同的理想气体从同一始态出发,分别经过恒温可逆膨胀到pV1和绝热可逆膨胀到pV2,两过程的体积功分别为W1和W2。若V1 =V2,正确的是( )。
A:p1p2,W1>W2
B:p1p2,W1W2
C:p1>p2,W1>W2
D:p1>p2,W1W2
答案: p1>p2,W1W2
物质的量相同的理想气体从同一始态出发,分别经过恒温可逆压缩到TV1和绝热可逆压缩到TV2,两过程的体积功分别为W1和W2。若V1 =V2,正确的是( )。
A:T1>T2,W1>W2
B:T1>T2,W1W2
C:T1T2,W1W2
D:T1T2,W1>W2
答案: T1T2,W1W2
物质的量相同的理想气体从同一始态出发,分别经过恒温可逆绝热可逆和绝热不可逆过程膨胀到相同的体积,三个过程的终态压力分别为pp2和p3,则正确的是( )。
A:p1p3p2
B:p1>p3>p2
C:p1p2p3
D:p1>p2>p3
答案: p1>p3>p2
关于焓的说法正确的是( )。
A:封闭系统的绝对焓可知
B:封闭系统的焓等于U与pV之和
C:封闭系统的焓变等于恒压热
D:封闭系统的焓等于恒压热
答案: 封闭系统的焓等于U与pV之和
隔离系统中发生任意变化后,正确的是( )。
A:ΔU=0,ΔH>0
B:ΔU=0,ΔH不确定
C:ΔU=0,ΔH D:ΔU=0,ΔH=0
答案: ΔU=0,ΔH不确定
1mol 双原子理想气体从300 K100kPa的始态,恒容变化到压力为200kPa的终态。过程
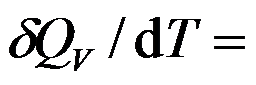
( )J·mol-1·K-1。
A:
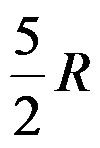
B:
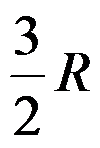
C:
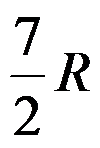
D:
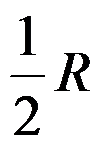
答案:
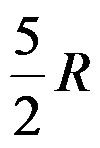
1mol双原子理想气体的
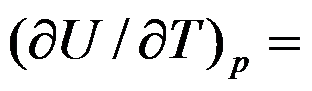
( )。
A:
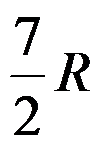
B:
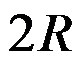
C:
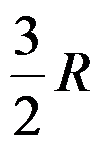
D:
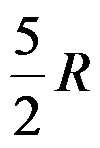
答案:
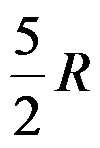
1mol双原子理想气体在恒容下温度升高1K,过程的ΔH =( )J。
A:
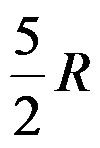
B:
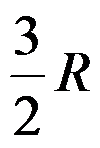
C:
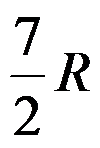
D:
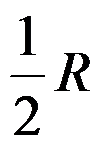
答案:
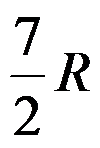
关系式
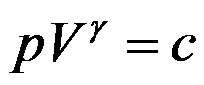
(c为常数)适用于( )。
A:任何气体的绝热过程
B:理想气体的绝热过程
C:理想气体的可逆绝热过程
D:任何气体的可逆绝热过程
答案: 理想气体的可逆绝热过程
一定量的理想气体从同一始态出发,分别经恒温可逆和绝热可逆两个过程压缩到相同压力的终态,两个终态的体积和焓分别为(V1H1)和(V2H2),则( )。
A:V1V2,H1H2
B:V1=V2,H1=H2
C:V1>V2,H1H2
D:V1>V2,H1>H2
答案: V1V2,H1H2
理想气体经节流膨胀过程后,则( )。
A:
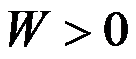
,
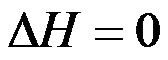
B:
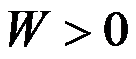
,
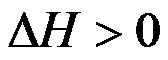
C:
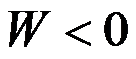
,
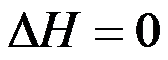
D:
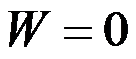
,
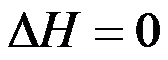
答案:
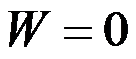
,
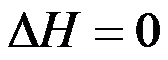
100℃101.325kPa的液体水在恒温恒压下蒸发为100℃101.325kPa的水蒸气,正确的是( )。
A:
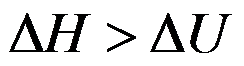
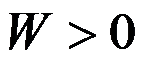
B:
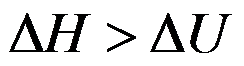
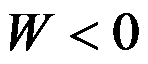
C:
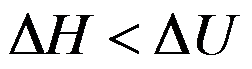
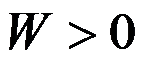
D:
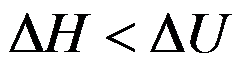
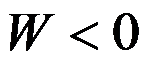
答案:
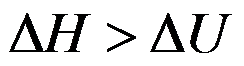
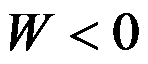
在一定温度和压力范围内,液体的摩尔蒸发焓随温度的变化率
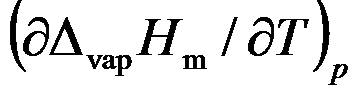
( )。
A:=0
B:不确定
C:>0
D: 答案:
根据标准摩尔燃烧焓的定义,不正确的是( )。
A:
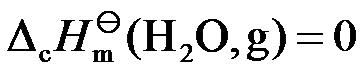
B:
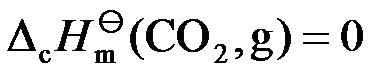
C:
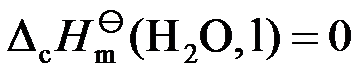
D:
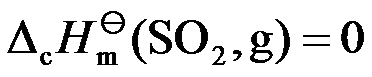
答案:
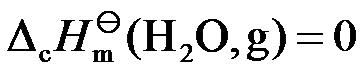
已知A(g)B(g)和C(l)的
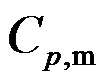
分别为20和40
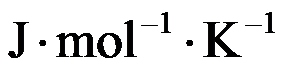
,若反应2A(g)+B(g)→C(l)在500K时的
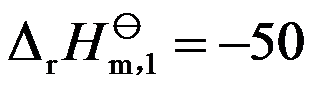
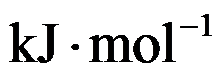
,则反应在1000K时的
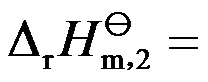
( )
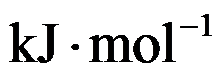
。
A:-55
B:-50
C:-70
D:-30
答案: -50
卡诺(Carnot)循环(工作介质为理想气体)由恒温可逆膨胀绝热可逆膨胀恒温可逆压缩和绝热可逆压缩四个过程组成,各过程的体积功依次为
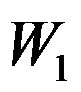
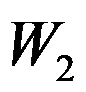
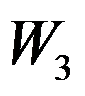
和
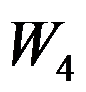
,关系正确的是( )。
A:
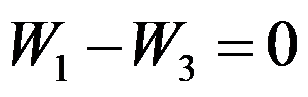
B:
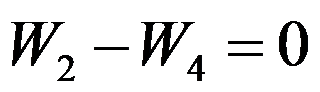
C:
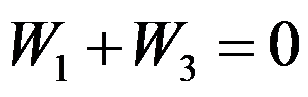
D:
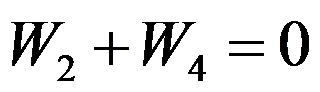
答案:
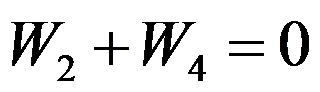
以水蒸气为工作介质,工作在240℃和30℃两热源之间热机的最大效率
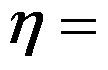
( )%。
A:87.5
B:12.5
C:40.9
D:69.3
答案: 40.9
在温度为800K的高温热源和温度为300K的低温热源之间工作的卡诺(Carnot)热机,热机放给低温热源的热150kJ,则热机从高温热源吸热
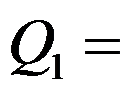
( )kJ。
A:-240
B:400
C:-400
D:240
答案: 400
实际气体CO2经节流膨胀后,温度下降,则( )。
A:ΔS(体)>0,ΔS(环)=0
B:ΔS(体)>0,ΔS(环) C:ΔS(体)0
D:ΔS(体) 答案: ΔS(体)>0,ΔS(环)=0
下列叙述中错误的是( )。
A:熵是用来衡量系统混乱程度的
B:熵是状态函数
C:“既要马儿跑,又要马儿不吃草”是不可能的
D:熵增过程都是自发的
答案: 熵增过程都是自发的
根据熵的统计意义,熵值增大的过程是( )。
A:石灰石分解生成石灰
B:水蒸气冷却成水
C:理想气体绝热可逆膨胀
D:乙烯聚合成聚乙烯
答案: 石灰石分解生成石灰
实际气体经过绝热可逆压缩,过程的熵变( )。
A: B:不确定
C:=0
D:>0
答案: =0
1molAg(s)在等容下由273.15K加热到303.15K,已知在该温度区间内Ag(s)的CV,m=24.48J·K-1·mol-1,过程的熵变为( )。
A:2.551J·K-1
B:25.51J·K-1
C:5.622J·K-1
D:56.22J·K-1
答案: 2.551J·K-1
计算熵变的公式
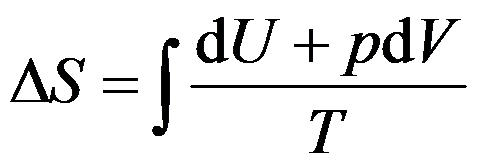
适用于( )。
A:封闭系统的任意变化过程
B:理想气体的简单状态变化
C:无非体积功的封闭系统的简单状态变化
D:理想气体的任意变化过程
答案: 无非体积功的封闭系统的简单状态变化
300K时,2mol理想气体等温膨胀到体积加倍,过程的ΔS(J·K-1)( )。
A:11.52
B:-11.52
C:5.76
D:-5.76
答案: 11.52
公式ΔS=ΔH/T适用于( )。
A:绝热过程
B:恒压过程
C:恒温过程
D:可逆相变过程
答案: 可逆相变过程
属于恒熵过程的是( )。
A:理想气体的恒温可逆过程
B:某液体在正常沸点下的相变过程
C:理想气体的绝热可逆膨胀过程
D:理想气体的恒温不可逆过程
答案: 理想气体的绝热可逆膨胀过程
热力学第三定律可以表述为( )。
A:0K时纯物质晶体的熵值为零
B:0K时纯物质完美晶体的熵值为零
C:0℃时纯物质晶体的熵值为零
D:0℃时纯物质完美晶体的熵值为零
答案: 0K时纯物质完美晶体的熵值为零
恒温时,封闭系统中亥姆霍兹函数的降低值等于( )。
A:系统对外所做非体积功的值
B:系统对外所做体积功的值
C:系统对外所做体积功和非体积功的总值
D:可逆条件下系统对外所做体积功和非体积功的总值
答案: 可逆条件下系统对外所做体积功和非体积功的总值
300K时,某一等温过程的
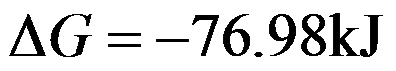
,
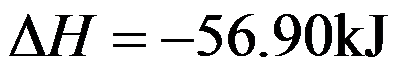
,则
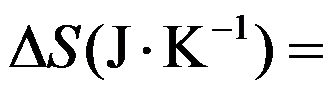
( )。
A:703
B:-18.40
C:66.93
D:-66.93
答案: 66.93
100℃101.325kPa的液体水真空条件下蒸发成为100℃101.325kPa下的水蒸气,正确的是( )。
A:
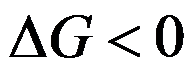
,不可逆
B:
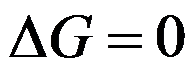
,可逆
C:
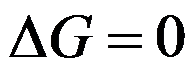
,不可逆
D:
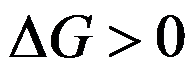
,不可能
答案:
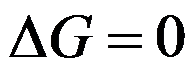
,不可逆
在298K时,反应H2(g)+Cl2(g)=2HCl(g)的
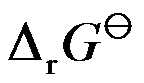
和
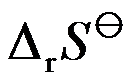
分别为
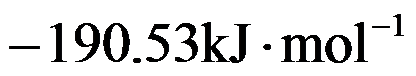
和
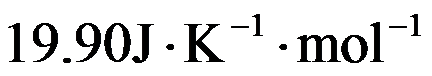
,则HCl(g)的标准摩尔生成焓为( )。
A:
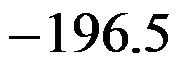
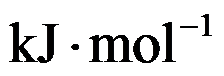
B:
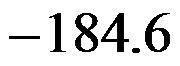
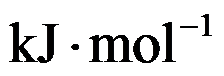
C:
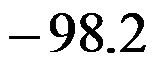
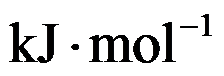
D:
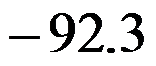
答案:
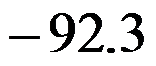
根据热力学基本方程式,
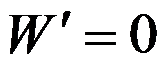
的封闭系统中
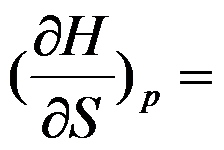
( )。
A:
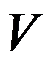
B:
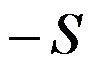
C:
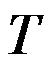
D:
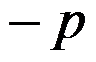
答案:
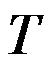
根据热力学基本方程式,
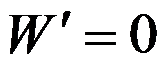
的封闭系统中
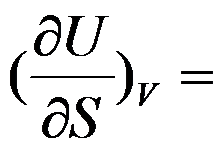
( )。
A:
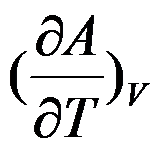
B:
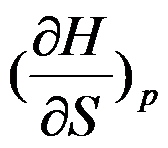
C:
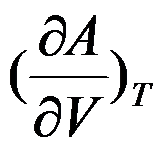
D:
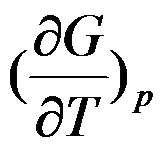
答案:
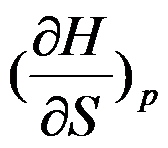
的封闭系统中,属于强度性质的偏微分是( )。
A:
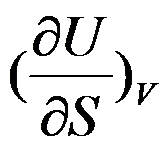
B:
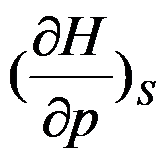
C:
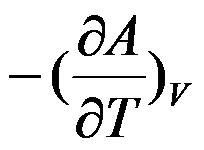
D:
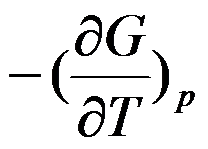
答案:
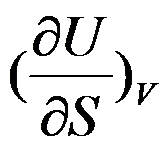
恒外压变化过程,系统的终态压力一定等于外压。( )
A:对
B:错
答案: 错
对于封闭系统,若始态和终态确定后,热力学能有定值。( )
A:错
B:对
答案: 错
U 是状态函数,因为△U = QV,故QV是特定条件下的状态函数。( )
A:对
B:错
答案: 错
在没有发生化学反应且没有相变时,均相封闭系统升高单位热力学温度所吸收的热,称为热容。( )
A:错
B:对
答案: 错
因为
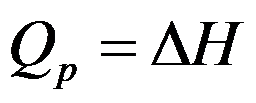
,故公式
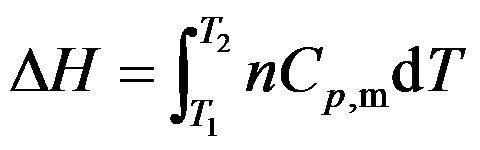
只适用于理想气体的恒压过程焓变的计算。( )
A:错
B:对
答案: 错
因为
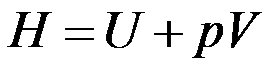
,所以公式
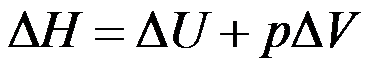
适用于一切变化过程。( )
A:对
B:错
答案: 错
若反应C(石墨)+1/2O2(g)→CO(g)和2C(石墨)+O2(g)→2CO(g)生成CO(g)物质的量相同,则它们的反应进度也相同。( )
A:对
B:错
答案: 错
实际气体的标准态是指任意温度标准压力
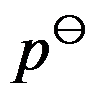
下表现出理想气体性质的纯气体状态。( )
A:对
B:错
答案: 对
热功转换的关系是,热可以无条件地全部转化为功,而功却不能无条件地全部转化为热。( )
A:对
B:错
答案: 错
从单一热源吸热后全部用来对外作功的热机,称为第一类永动机。( )
A:对
B:错
答案: 错
绝热循环过程一定是个可逆循环过程。( )
A:对
B:错
答案: 对
自发过程的熵变△S > 0。( )
A:错
B:对
答案: 错
理想气体等温可逆膨胀过程熵值不变。( )
A:对
B:错
答案: 错
封闭系统中理想气体的恒温变化过程,一定存在∆G = ∆A。( )
A:错
B:对
答案: 对
由物质的标准摩尔生成吉布斯(Gibbs)函数的定义可知,298K时

。( )
A:错
B:对
答案: 错
根据热力学基本方程式可知,
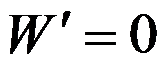
的封闭系统中偏微分
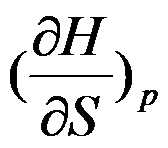
属于强度性质。( )
A:错
B:对
答案: 对
根据热力学基本方程式可知,
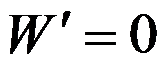
的封闭系统中偏微分
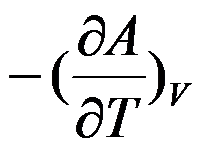
属于强度性质。( )
A:对
B:错
答案: 错
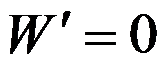
体积一定的封闭系统中,热力学能随熵的增加而增加。( )
A:错
B:对
答案: 对
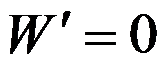
压力恒定的封闭系统中,焓随熵的增加而增加。( )
A:对
B:错
答案: 对
某溶液由2mol A物质和1.5mol B 物质混合而成,总体积为0.42 m3,已知A的偏摩尔体积为0.03m3·mol-1,则组分B的偏摩尔体积为( )。
A:0.20 m3·mol-1
B:0.28 m3·mol-1
C:0.30 m3·mol-1
D:0.24 m3·mol-1
答案: 0.24 m3·mol-1
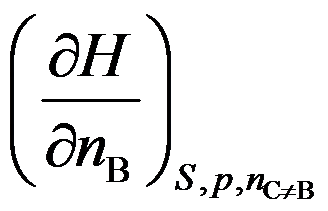
表示( )。
A:化学势
B:偏摩尔量
C:既不是偏摩尔量,又不是化学势
D:既是偏摩尔量,又是化学势
答案: 化学势
今有298Kpy的N2(状态Ⅰ)和323Kpy的N2(状态Ⅱ)各一瓶,瓶中N2 的化学势大小为( )。
A:μ(Ⅰ)=μ(Ⅱ)
B:不可比较
C:μ(Ⅰ)μ(Ⅱ)
D:μ(Ⅰ)>μ(Ⅱ)
答案: μ(Ⅰ)>μ(Ⅱ)
在
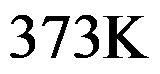
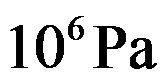
下液态水和气态水的化学势m(l)和m(g)的关系为( )。
A: m(l)<m(g)
B:m(l)= m(g)
C:m(l)>m(g)
D:无法确定
答案: m(l)<m(g)
373Kpy时H2O(g) 的化学势为μ1;373K0.5 py时H2O(g) 的化学势μ2,那么:(1)
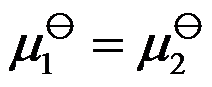
;(2)μ2 – μ1 =RTln2; (3)μ2-μ1 =-RTln2; (4)μ2 = μ1-RTln0.5。以上四条中正确的是( )。
A:(1) (2)
B:(1) (3)
C:(2) (4)
D:(3) (4)
答案: (1) (3)
在给定温度下,当p→0时,实际气体的逸度与压力的正确关系式应为( )。
A:在p→0时,f/p>1
B:在p→0时,f/p=1
C:在p→0时,fp
D:在p→0时,f/p<1
答案: 在p→0时,f/p=1
拉乌尔(Raoult)定律适用于( )。
A:稀溶液中的溶质
B:真实溶液中的溶剂
C:稀溶液中的溶剂
D:稀溶液中的溶剂及溶质
答案: 稀溶液中的溶剂
关于亨利常数,下列说法中正确的是( )。
A:其值与温度溶质和溶剂性质及浓度的标度有关
B:其值与温度溶质性质和浓度有关
C:其值与温度溶剂性质和浓度有关
D:其值与温度浓度和压力有关
答案: 其值与温度溶质和溶剂性质及浓度的标度有关
A和B形成理想的液态混合物,50℃时纯A的饱和蒸气压为 84 kPa,纯B的为 35 kPa。50℃时与液相组成 xA=0.75的液体平衡的气相组成 yA=( )。
A:0.75
B:0.42
C:0.71
D:0.88
答案: 0.88
两液体的饱和蒸气压分别为p*Ap*B,它们混合形成理想液态混合物,液相组成为x,气相组成为y,若p*A>p*B ,则( )。
A:yB>yA
B:yA>yB
C:yA>xA
D:xA>yA
答案: yA>xA
由AC两种组分组成的理想液态混合物,有( )。
A:混合过程中,体系的热力学性质均没有改变
B:A与C两种组分的分子间作用力为零
C:其中只有一种组分服从拉乌尔(Raoult)定律
D:任意一组分的化学势为:
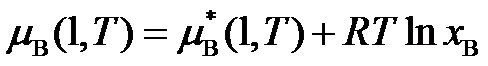
答案: 任意一组分的化学势为:
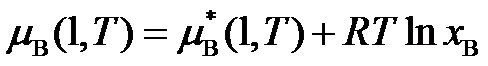
在280 K时,有5 mol邻二甲苯与5mol间二甲苯形成理想液态混合物,则ΔmixG( )。
A:ΔmixG=-16.14 kJ
B:ΔmixG=0
C:ΔmixG > 0
D:ΔmixG=-16.14 J
答案: ΔmixG=-16.14 kJ
过饱和溶液中溶剂的化学势比纯溶剂的化学势( )。
A:无法判断
B:相等
C:低
D:高
答案: 低
下述系统中的组分B,选择假想标准态的是( )。
A:稀溶液中的溶质
B:理想液态混合物中的组分B
C:稀溶液中的溶剂
D:混合理想气体中的组分B
答案: 稀溶液中的溶质
将非挥发性溶质溶于溶剂中形成稀溶液时,将引起( )。
A:蒸气压升高
B:熔点升高
C:沸点升高
D:都不对
答案: 沸点升高
盐碱地的农作物长势不良,甚至枯萎,其主要原因是( )。
A:肥料不足
B:水分从植物向土壤倒流
C:很少下雨
D:天气太热
答案: 水分从植物向土壤倒流
冬季建筑施工中,为了保证施工质量,常在浇注混凝土时加入盐类,现有下列几种盐,具有理想效果的是( )。
A:NaCl
B:CaCl2
C:KCl
D:NH4Cl
答案: CaCl2
对真实溶液中的溶质,当选假想的符合亨利(Henry)定律的xB=1 的状态为标准态时,下列结果正确的是( )。
A:xB→1时,aB= xB
B:xB→0时,aB= xB
C:xB→1时,γB= xB
D:xB→1时,γB= aB
答案: xB→0时,aB= xB
氯仿 (1) 和丙酮 (2) 形成非理想液态混合物,在T 时,测得总蒸气压为29398 Pa,蒸气中丙酮的物质的量分数 y2= 0.818, 而该温度下纯氯仿的饱和蒸气压为 29571 Pa,则在溶液中氯仿的活度a1为( )。
A:0.500
B:0.823
C:0.181
D:0.813
答案: 0.181
因为只有容量性质才有偏摩尔量,所以偏摩尔量都是容量性质。( )
A:对
B:错
答案: 错
同一系统的各个偏摩尔量之间彼此无关。( )
A:对
B:错
答案: 错
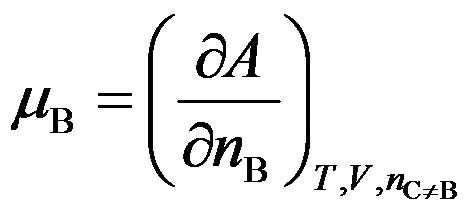
是偏摩尔量,又是化学势。( )
A:错
B:对
答案: 错
真实气体的
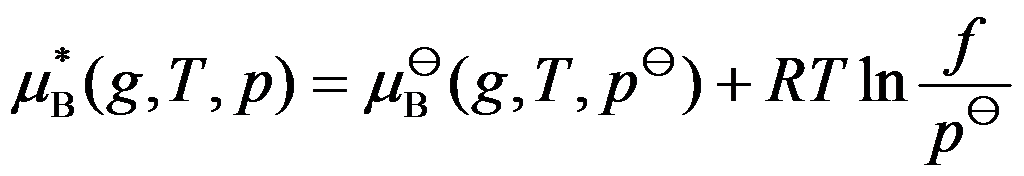
,因而利用此式可以求得真实气体混合物中B组分的化学势的值。( )
A:对
B:错
答案: 错
对于实际气体,能以逸度来表示
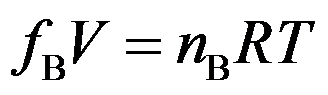
。( )
A:对
B:错
答案: 错
拉乌尔(Raoult)定律和亨利(Henry)定律既适合于理想液态混合物,也适合于稀溶液。( )
A:对
B:错
答案: 错
在一定的温度相同的压力和同一溶剂中,某气体的亨利系数越大,则此气体在该溶剂中的溶解度也越大。( )
A:对
B:错
答案: 错
亨利(Henry)定律和拉乌尔(Raoult)定律相似,描述的都是直线关系,都是压力与浓度之间的直线关系,因而二者可以互相替代。( )
A:错
B:对
答案: 错
理想液态混合物的热力学定义是
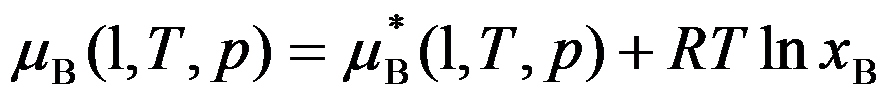
,即凡是溶液中有一物质的化学势在全部浓度范围内都能用这个公式表示者,则该溶液就称为理想液态混合物。( )
A:错
B:对
答案: 错
理想液态混合物中任一物质B的化学势表达式
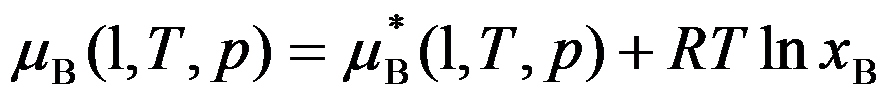
,其中
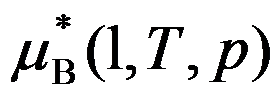
就是标准态下的化学势。( )
A:错
B:对
答案: 错
由AC两种组分组成的液态理想混合物,混合过程中,体系的热力学性质均没有改变。( )
A:错
B:对
答案: 错
水溶液的蒸气压一定小于同温度下纯水的饱和蒸气压。( )
A:对
B:错
答案: 错
渗透平衡时溶液中溶剂的化学势等于纯溶剂的化学势。( )
A:错
B:对
答案: 对
真实液态混合物中B组分的
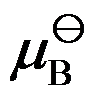
为
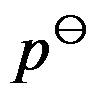
下纯液体B 的化学势。( )
A:对
B:错
答案: 对
在恒温恒压下,一个化学反应的
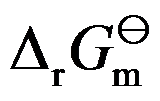
是指参加反应的各物质在下列哪种情况下反应吉布斯函数变( )。
A:标准态时
B:化学平衡时
C:可逆反应中
D:浓度不变时
答案: 标准态时
已知温度 T 时反应
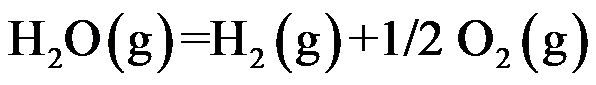
的标准平衡常数
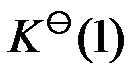
及反应
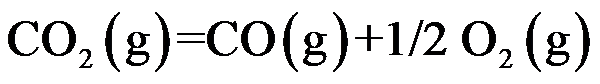
的标准平衡常数
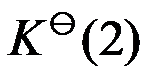
,则同温度下反应
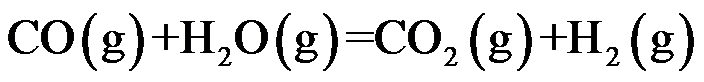
的标准平衡常数
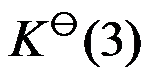
应为( )。
A:
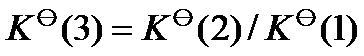
B:
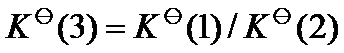
C:
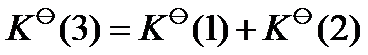
D:
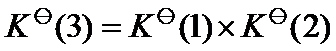
答案:
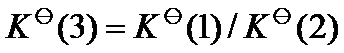
对于反应
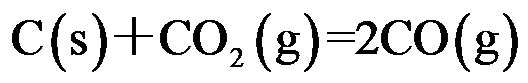
,下列各式正确的是( )。
A:
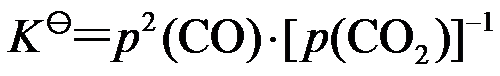
B:
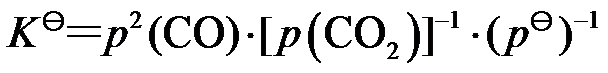
C:
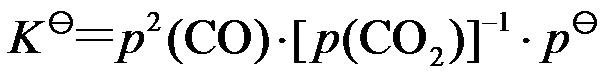
D:
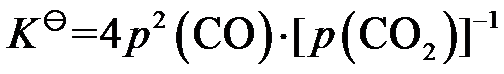
答案:
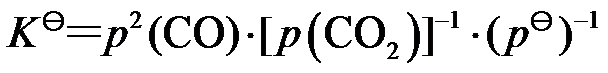
假设各反应中的气体都是理想气体,则
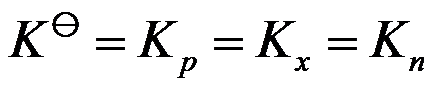
的反应是( )。
A:
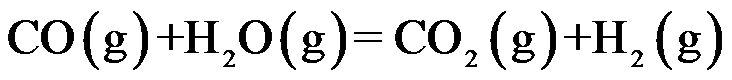
B:
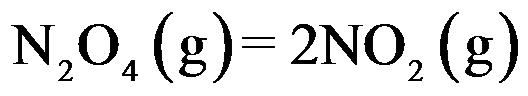
C:
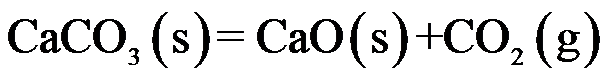
D:
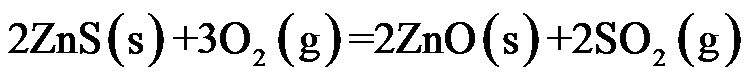
答案:
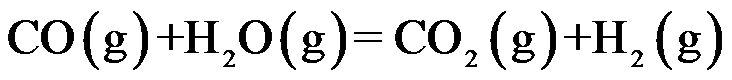
900℃时反应:
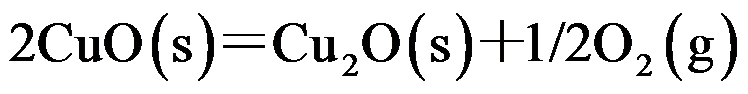
的
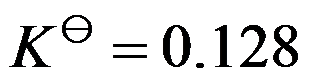
,则其平衡分解压力为( )。
A:791348.25 Pa
B:12969.6 Pa
C:835.9 Pa
D:1638.14Pa
答案: 1638.14Pa
在标准状态下,
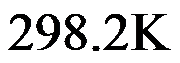
时,氧化汞的分解反应:
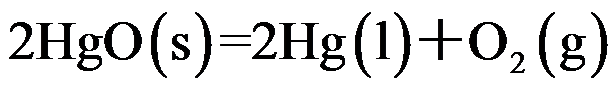
的分解压力为
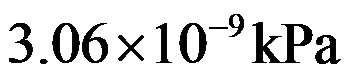
,
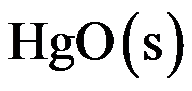
的标准摩尔生成吉布斯函数是( )
。
A:-60.0
B:60.0
C:30.0
D:-30.0
答案: -30.0
反应
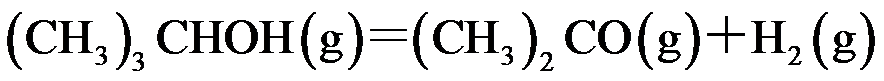
,在457.4 K 时
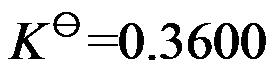
,
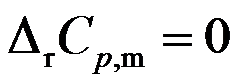
,在500 K时
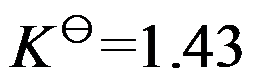
,则
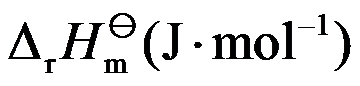
为( )。
A:0.615
B:6.150×103
C:6.15
D:6.150×104
答案: 6.150×104
巳知反应

;
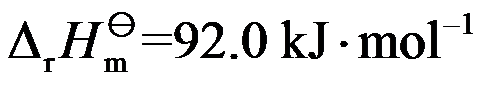
;
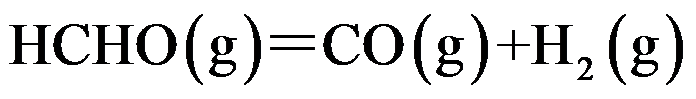
;
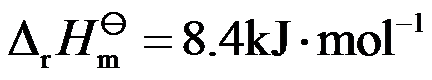
。若要提高平衡混合物中HCHO的含量, 应采取( )。
A:增加压力
B:降低温度
C:升高温度
D:减小压力
答案: 升高温度
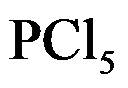
的分解反应是
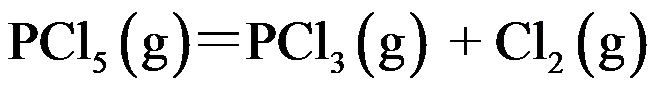
,在 473 K 达到平衡时,
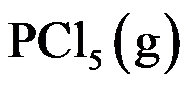
有 48.5% 分解,在 573 K 达到平衡时,有 97% 分解,则此反应为( )。
A:即不放热也不吸热
B:这两个温度下的平衡常数相等
C:放热反应
D:吸热反应
答案: 吸热反应
平衡常数
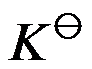
与温度 T 的关系为
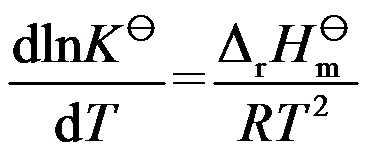
,当温度升高时,
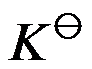
应该( )。
A:减小
B:不变
C:不能判断
D:增大
答案: 不能判断
对于反应
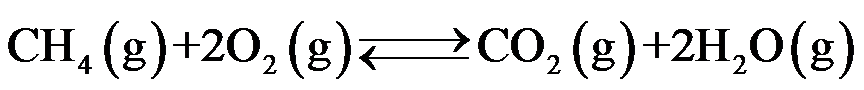
,在恒温下,增加反应系统的平衡压力,使其体积变小,这时,y(CO2)( )。
A:不变
B:变大
C:变小
D:无法确定
答案: 不变
在

反应中,若增加压强或降低温度,B的转化率均增大,则反应体系应是( )。
A:A是气体,C是固体,正反应放热
B:A是固体,C是气体,正反应吸热
C:A是气体,C是气体,正反应吸热
D:A是气体,C是气体,正反应放热
答案: A是气体,C是气体,正反应吸热
等温等压下加入惰性气体,对正反应有利的是( )。
A:
B:
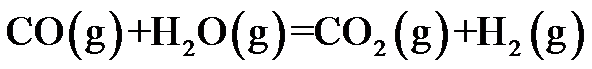
C:
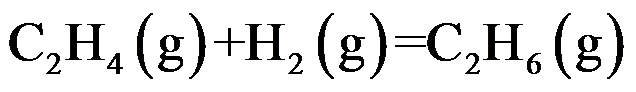
D:
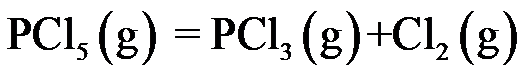
答案:
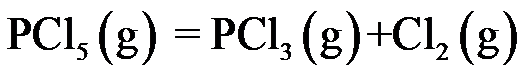
对于反应
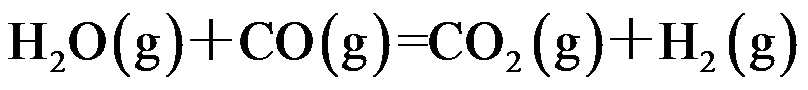
,下列哪些因素变化,不影响其转化率( )。
A:通入惰性气体
B:升高温度
C:通入 H2 气
D:降低温度同时增加压力
答案: 通入惰性气体
由反应
①
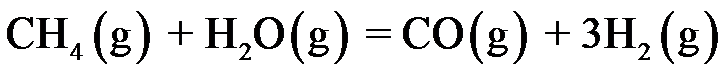
②
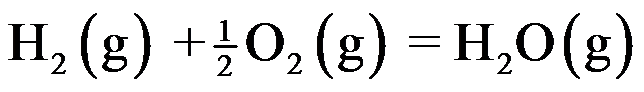
③
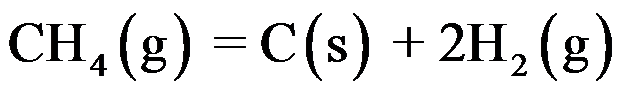
④
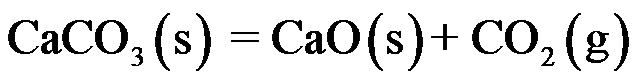
构成的几组反应中都可以建立同时平衡的是( )。
A:②③④
B:①③④
C:①②③
D:①②④
答案: ①②③
因为
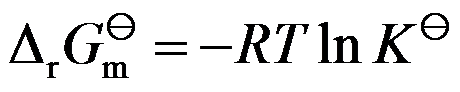
,所以
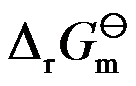
是平衡状态时的吉布斯函数变化。( )
A:对
B:错
答案: 错
对于理想气体混合物的反应,该反应的标准平衡常数仅仅是温度的函数。( )
A:错
B:对
答案: 对
已知 298 K 时,
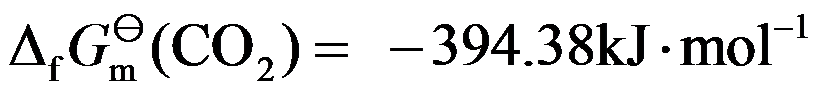
,
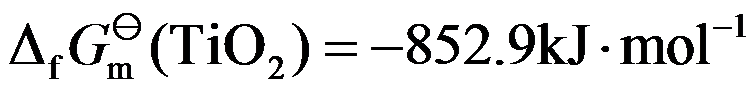
,则在 298 K 的标准态下,可以直接用碳来还原TiO2。( )
A:对
B:错
答案: 错
在等温等压条件下,
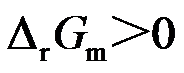
的反应一定不能进行。( )
A:对
B:错
答案: 错
等温等压且无非体积功的条件下,一切吸热且熵减少的过程,都不能自发进行。( )
A:错
B:对
答案: 对
温度T 时,若
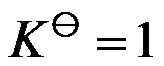
,说明这个反应在此温度,压力为 100kPa 的条件下已达到平衡。( )
A:错
B:对
答案: 错
在有纯凝聚相参加的理想气体反应中,
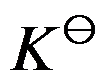
的表示式不包含液体(或固体)的分压。( )
A:对
B:错
答案: 对
若已知
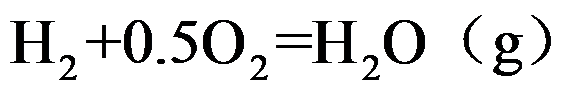
的平衡组成,则能求得
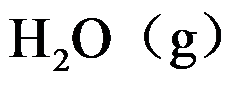
的标准摩尔生成吉布斯函数。( )
A:错
B:对
答案: 对
因
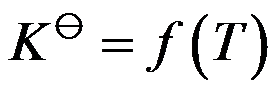
,所以对理想气体的化学反应,当温度一定时,其平衡组成也一定。( )
A:错
B:对
答案: 错
根据反应体系的平衡组成的测定可以计算该反应的热力学的变化值。( )
A:对
B:错
答案: 对
温度升高平衡常数增大的反应一定是吸热反应。( )
A:对
B:错
答案: 对
对于理想气体反应
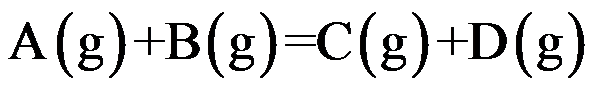
,其标准平衡常数与温度关系为
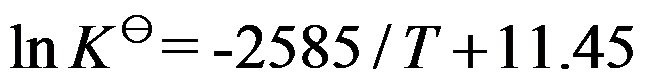
,则
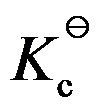
与温度的关系为
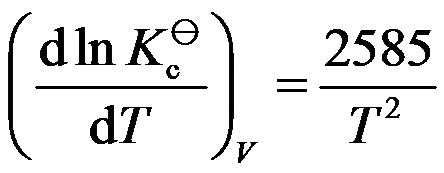
。( )
A:错
B:对
答案: 对
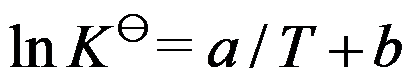
,升高温度,平衡向右移动,则
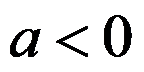
,
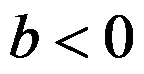
。( )
A:错
B:对
答案: 错
对摩尔数增加的反应和摩尔数减小的反应,温度对反应平衡的影响不同。( )
A:错
B:对
答案: 错
压力增大,平衡正向移动的理想气体反应一定是摩尔数减小的反应。( )
A:错
B:对
答案: 对
对于摩尔数增加的理想气体反应,充入惰性气体,平衡一定正向移动。( )
A:错
B:对
答案: 错
同时平衡体系中有几个反应,就可以列出几个独立的平衡常数表示式来计算平衡组成。( )
A:对
B:错
答案: 错
改变压力,同时平衡体系中的一个反应的组成发生改变,另一个反应的组成可能不变。( )
A:对
B:错
答案: 错
NH4HS(s)和任意量的NH3(g)及H2S(g)达平衡时,平衡系统的相数P组分数C和自由度数F分别为()。
A:
P=2,C=1,F=1
B:
P=2,C=2,F=2
C:
P=3,C=2,F=2
D:
P=2,C=3,F=3
答案:
P=2,C=2,F=2
在101325Pa的压力下,I2在液态水与CCl4中的溶解已达到平衡(无固体I2存在),此体系的自由度为()。
A:4
B:2
C:3
D:1
答案: 2
在0℃不存在固体I2的情况下,一定量的碘溶于H2O-CCl4系统中的自由度F为( )。
A:3
B:1
C:0
D:2
答案: 2
单组分系统两相平衡时,下列关系式或说法正确的是( )。
A:
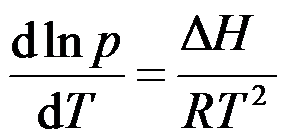
B:
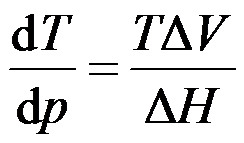
C:自由度是零
D:化学势是零
答案:
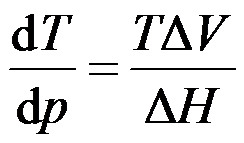
方程
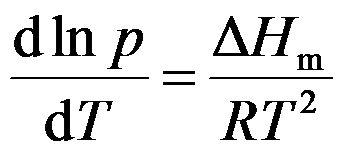
适用于( )过程。
A:
H2O(s)=H2O(g)
B:
NH4Cl(s)溶于水形成溶液
C:
H2O(s)=H2O(l)
D:
NH4Cl(s)=NH3(g)+HCl(g)
答案:
H2O(s)=H2O(g)
某晶体的两种晶形,在转换温度附近的蒸气压随温度变化的关系为:lgp1=﹣5082/T+11.364lgp1=-5555/T+12.564则两晶形的转换温度为( )。
A:392.2K
B:375.2K
C:494.2K
D:394.2K
答案: 394.2K
关于三相点,下面说法中正确的是( )。
A:三相点就是三条两相平衡线的交点
B:三相点是纯物质的三个相平衡共存时的温度和压力所决定的相点
C:纯物质和多组分系统均有三相点
D:三相点的温度可随压力改变
答案: 三相点是纯物质的三个相平衡共存时的温度和压力所决定的相点
某一固体在25 ℃和101325 Pa压力下升华,这意味着( )。
A:三相点压力大于101325Pa
B:固体比液体密度大
C:三相点压力小于101325Pa
D:三相点温度小于25℃
答案: 三相点压力大于101325Pa
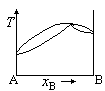
在温度为T时,A(l)与B(l)的饱和蒸气压分别为30.0kPa和35.0kPa,A与B完全互溶,当xA=0.5时,pA=10.0kPa,pB=15.0kPa,则此两组分双液系常压下的T~x相图为( )。
A:
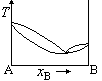
B:
C:
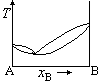
D:
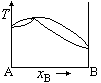
答案:

在一定压力下,若在AB二组分系统的温度–组成图(即T–xB)中出现最高恒沸点,则其蒸气总压对拉乌尔定律必产生( )。
A:纯B
B:不一定
C:高共沸混合物
D:纯A
答案: 不一定
已知A和B二组分可形成具有最低恒沸点(xB=0.7)的完全互溶双液系。若把xB=0.4的溶液进行精馏时,在塔顶得到的是( )。
A:最低恒沸混合物
B:纯B(l)
C:不确定
D:纯A(l)
答案: 最低恒沸混合物
对恒沸混合物的描述,下列各种叙述中不正确的是( )。
A:其沸点随外压的改变而改变
B:不具有确定的组成
C:与化合物一样,具有确定的组成
D:平衡时,气相和液相的组成相同
答案: 与化合物一样,具有确定的组成
如图,对于形成简单低共熔混合物的两组分系统相图,当系统的组成为x,冷却到tºC时,固–液两相的重量之比是( )。

A:
m(s)∶m(l) = bc∶ab
B:
m(s)∶m(l) = bc∶ac
C:
m(s)∶m(l) = ac∶bc
D:
m(s)∶m(l) = ac∶ab
答案:
m(s)∶m(l) = ac∶bc
液体A与液体B不相混溶。在一定温度T0下,当有B存在并且达到平衡时,液体A的蒸气压应为( )。
A:与体系中A的摩尔分数成比例
B:
与T0下纯B的蒸气压之和等于体系的总压
C:大于T0下纯A的蒸气压
D:等于T0下纯A的蒸气压
答案: 等于T0下纯A的蒸气压
如图,对于形成简单低共熔混合物的二组分系统相图,当系统点分别处于CEG点时,对应的平衡共存的相数为( )。
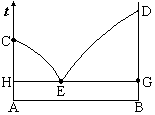
A:C点2,E点3,G点1
B:C点1,E点3,G点3
C:C点2,E点3,G点3
D:C点1,E点1,G点1
答案: C点2,E点3,G点1
A及B两组分组成的凝聚系统能生成三种稳定的化合物,则于常压下在液相开始冷却的过程中,最多有( )种固相同时析出。
A:3
B:4
C:2
D:5
答案: 2
Na2CO3可形成三种水合盐:Na2CO3·H2ONa2CO3·7H2ONaCO3·10H2O,在常压下,将Na2CO3投入冰–水混合物中达三相平衡时,若一相是冰,一相是Na2CO3水溶液,则另一相是( )。
A:
Na2CO3·10H2O
B:
Na2CO3
C:
Na2CO3·H2O
D:
Na2CO3·7H2O
答案:
Na2CO3·10H2O
在CaF2-CaCl2的凝聚系统相图中,系统点为a,当降低系统温度时,不正确的是( )。
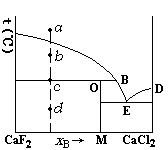
A:
d点P = 2,F * = 1
B:
c点P = 2,F * = 1
C:
a点P = 1,F* = 2
D:
b点P = 2,F * = 1
答案:
c点P = 2,F * = 1
A和B两组分凝聚系统相图如图所示,在下列叙述中错误的是( )。
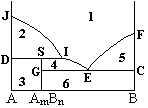
A:
JFEI和S诸点F = 0
B:
要分离出纯AmBn,系统点必须在6区内
C:
GC直线DI直线上的点,F = 0
D:
1为液相,P = 1,F = 2
答案:
要分离出纯AmBn,系统点必须在6区内
如图A与B是两组分恒压下固相部分互溶凝聚体系相图,图中有( )个单相。
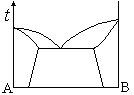
A:4
B:1
C:2
D:3
答案: 3
虽然相是均匀的,但并非一定要连续。( )
A:对
B:错
答案: 对
液体按其互溶程度可以是一相也可以是两相或三相共存。( )
A:错
B:对
答案: 对
相图上系统点与相点都是分开的。( )
A:对
B:错
答案: 错
相图可表示出达到相平衡所需的时间长短。( )
A:对
B:错
答案: 错
依据相律,纯液体在一定温度下,蒸气压应该是定值。( )
A:对
B:错
答案: 对
在推导相律时,C个组分必须在每一相中都存在。( )
A:对
B:错
答案: 错
在使用克劳修斯-克拉佩龙方程时,物质的量只能取1mol。( )
A:对
B:错
答案: 对
三相点通常是在很靠近正常沸点的某一温度。( )
A:对
B:错
答案: 错
单组分单相系统是双变量系统,即系统的温度T和压力p可以同时改变,在p–T图中应是一个面。( )
A:错
B:对
答案: 对
水的三相点的温度是273.15 K,压力是610.62 Pa。( )
A:错
B:对
答案: 错
多组分液体的沸点是指在一定外压下,溶剂的蒸气压与外压相等时的温度。( )
A:错
B:对
答案: 错
在一定外压下,多组分体系的沸点随组分及浓度而变化。( )
A:错
B:对
答案: 对
对于对拉乌尔定律产生最大正偏差的二组分气液平衡系统,可以用蒸馏或者精馏的方法将两个组分分离成纯组分。( )
A:对
B:错
答案: 错
恒沸混合物与化合物一样,具有确定的组成。( )
A:错
B:对
答案: 错
在部分互溶双液系相图中,两条溶解度曲线把相图区域围出了一个帽形区。帽形区以外,溶液为单一液相;帽形区以内,溶液分为两相。( )
A:错
B:对
答案: 对
部分互溶双液系,一定温度下若出现气液两相平衡,则两相的组成与系统的总组成无关,且两相的量之比为常数。( )
A:错
B:对
答案: 错
部分互溶双液系,一定温度下若出现气液两相平衡,则两相的组成不定。( )
A:错
B:对
答案: 错
有一种不溶于水的有机化合物,在高温时易分解,欲将其提纯,可采用水蒸气蒸馏法。( )
A:错
B:对
答案: 对
在有化合物生成的固-液系统中,形成化合物的形式有多种,可以形成水和盐复盐复合氧化物复合有机化合物以及两种金属形成的金属化合物等。( )
A:对
B:错
答案: 对
对于具有同种晶型,分子原子或离子大小相近的两种物质,一种物质晶体中的粒子可以被另一种物质的相应粒子以任意比例取代,易形成固相完全互溶固-液系统。( )
A:对
B:错
答案: 对
测池急草痕响缎暴狮交厘讥天
覆快圣山肩芍蹄港谈堂合阑舱