突沃诺行伴法绅醚湘隙纲稗台
韩铺袒吩菇孺盖墟冒澜倦横图
A B C D 答案 以下溶液稀释10倍时pH改变最大的是
答案:点击这里查看答案
点击这里,查看基础化学原理(山东联盟) 2024智慧树答案完整版
如需获取更多网课答案,可在浏览器访问我们的网站:http://www.mengmianren.com/


注:请切换至英文输入法输入域名,如果没有成功进入网站,请输入完整域名:http://www.mengmianren.com/
已知298.15 K101.325 kPa下, 反应 2 H2 (g) + O2 (g) → 2 H2O (g) 的
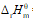
= -483.64 kJ·mol-1, 则H2O (g) 的
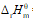
为
A –483.64 kJ·mol-1
B –241.82 kJ·mol-1
C 241.82 kJ·mol-1
D 483.64 kJ·mol-1
答案 –241.82 kJ·mol-1
下列关于化学计量数和反应进度说法错误的是
A 反应物的化学计量数为正数,产物的化学计量数为负数
B 同一化学反应如果化学反应方程式的写法不同,反应进度ξ会有所不同
C 同一化学反应方程式,反应进度ξ的值与选用反应式中何种物质的量的变化进行计算无关
D 用反应进度定义的反应速率的量值与表示速率物质的选择无关
答案 反应物的化学计量数为正数,产物的化学计量数为负数
下列热力学函数不等于零的是
A DfHmq298.15(Br2,l)
B Smq298.15(石墨,s)
C DfHmq298.15(石墨,s)
D DfGmq298.15(Fe,s )
答案 Smq298.15(石墨,s)
某体系从环境吸收了50 kJ的热后,体系对环境做功100 kJ,则体系内能的变化是
A 50 kJ
B -150 kJ
C -100 kJ
D -50 kJ
答案 -50 kJ
下列各项中不属于状态函数的是
A 熵
B 自由能
C 功
D 焓
答案 功
下列单质的ΔfHmθ不等于零的是
A Fe(s)
B C(石墨)
C Ne (g)
D Cl2(l)
答案 Cl2(l)
体系对环境作功20 kJ,并从环境吸热10 kJ,则体系内能的变化是
A +30 kJ
B +10 kJ
C -10 kJ
D -30 kJ
答案 -10 kJ
不属于状态函数的物理量为
A 焓
B 内能
C 熵
D 热
答案 热
下列纯态物质中,标准摩尔生成焓不等于零的是
A Hg (l)
B Br2 (l)
C 金刚石
D I2 (s)
答案 金刚石
热的物体比冷的物体含有更多的热量
A 对
B 错
答案 错
化学计量数可取整数和分数,但不能取负数
A 对
B 错
答案 错
热是一种传递中的能量
A 对
B 错
答案 对
同一体系,不同状态可能有相同的热力学能值
A 对
B 错
答案 对
化学计量数和反应进度均与化学反应方程式的书写有关,而且其数只取正数
A 对
B 错
答案 错
系统状态一定,状态函数就有确定的值
A 对
B 错
答案 错
某反应的反应进度x = 1mol,表示该反应按计量系数关系进行,得到1mol产物
A 对
B 错
答案 错
下列关于热效应的说法不对的是
A 恒容反应热等于体系内能的变化
B 恒压反应热等于体系的焓变
C 恒容反应热等于体系的焓变
D 对于固相或液相反应,公式ΔH = ΔU成立
答案 恒容反应热等于体系的焓变
下列各热化学方程式的热效应符合物质标准摩尔生成焓
定义的是:
A O2 (g) + 2 H2 (g) → 2 H2O (g)
B H2 (g) + I2 (g) → 2HI (g)
C C (石墨,s) + O2 (g) → CO2 (g)
D O2 (g) + 2 H2 (g) → 2 H2O (l)
答案 C (石墨,s) + O2 (g) → CO2 (g)
下列关于体系和环境说法正确的是
A 敞开体系中体系与环境之间没有物质交换但有能量交换
B 封闭体系中体系与环境之间有能量交换也有物质交换
C 孤立体系中体系与环境之间既无物质交换也无能量交换
D 孤立体系中体系与环境之间没有物质交换但有能量交换
答案 孤立体系中体系与环境之间既无物质交换也无能量交换
下列热力学函数不为零的是
A
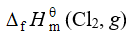
B
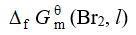
C
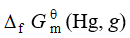
D
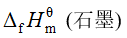
答案
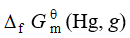
一个在任何温度下都能自发的反应,属于下列哪种情况
A △H 0, △S>0
C △H0
D △H >0, △S 答案 △H0
如果一个反应的吉布斯自由能变为零,则反应
A 能自发进行
B 是吸热反应
C 是放热反应
D 处于平衡状态
答案 处于平衡状态
对于某一反应,有催化剂和无催化剂作用时,下列说法正确的是
A 催化反应比无催化反应的焓变大
B 催化反应比无催化反应的活化能小
C 两种反应的正反应速率一样大
D 催化反应比无催化反应的平衡常数大
答案 催化反应比无催化反应的活化能小
已知反应aA + bB

cC,当cAcB各增大一倍时,反应速率变为原来的两倍,则该反应的反应级数为
A 0
B 1
C 2
D 3
答案 1
下列叙述正确的是
A 在恒压下,凡是自发的过程一定是熵增的
B 焓是状态函数,而恒压反应的焓变等于恒压反应热,故热也是状态函数
C 单质在298.15K时,Smθ为零
D 恒温恒压不做非体积功的条件下,体系自由能减少的过程都是自发进行的
答案 恒温恒压不做非体积功的条件下,体系自由能减少的过程都是自发进行的
反应2A(g) =C (g) △H >0,提高A(g)的转化率的方法有
A 高温高压
B 低温低压
C 低温高压
D 高温低压
答案 高温高压
已知某反应的△H
A 任何温度下反应自发进行
B 任何温度下正反应不能自发进行
C 低温时正反应可以自发进行
D 高温时正反应可以自发进行
答案 低温时正反应可以自发进行
下列纯态物质中,标准摩尔生成自由能变不等于零的是
A Hg (l)
B Br2 (g)
C 石墨
D Fe (s)
答案 Br2 (g)
当速率常数的单位为S-1时,反应级数为
A 0
B 1
C 2
D 3
答案 1
对一个特定反应来讲,有关标准平衡常数 Kθ的描述,错误的是
A 增加反应物浓度,Kθ不变
B 减少产物浓度,Kθ不变
C 加入催化剂,Kθ不变
D 改变反应温度,Kθ不变
答案 改变反应温度,Kθ不变
催化剂能加快反应的速率,它的作用机理是
A 增大碰撞频率
B 改变反应途径,降低活化能
C 减小速率常数
D 增大平衡常数
答案 改变反应途径,降低活化能
反应2A(g) + B(s) →C (g) △H
A 高温高压
B 低温低压
C 低温高压
D 高温低压
答案 低温高压
已知某反应的高温时正反应可以自发进行,则△H, △S的取值为
A △H>0, △S>0
B △H0, △S D △H0
答案 △H>0, △S>0
质量作用定律适用于任何化学反应
A 对
B 错
答案 错
冰在室温下自动熔化成水,是熵增起了主要作用
A 对
B 错
答案 对
放热反应均是自发反应
A 对
B 错
答案 错
平衡常数和转化率都能表示反应进行的程度,但平衡常数与浓度无关,而转化率与浓度有关
A 对
B 错
答案 对
放热且混乱度变小的反应一定是自发反应
A 对
B 错
答案 错
平衡常数是衡量反应进行程度的特征常数,其大小只与温度有关,与计量数无关
A 对
B 错
答案 错
质量作用定律只适用于一级反应
A 对
B 错
答案 错
质量作用定律适用于双分子的简单化学反应
A 对
B 错
答案 错
当化学反应处于平衡状态时,正逆反应速率相等,反应混合物中各组分的平衡浓度相等
A 对
B 错
答案 错
质量作用定律只适用于单分子反应的基元反应
A 对
B 错
答案 错
平衡常数和转化率均表示反应进行的程度,但平衡常数与浓度无关,而转化率与浓度有关
A 对
B 错
答案 对
下列反应达平衡时,2 SO2(g) + O2 (g) = 2 SO3 (g) , 保持体积不变,加入惰性气体使总压力增加一倍,则
A 平衡向左移动
B 衡向右移动
C 平衡不发生移动
D 条件不足,不能判断
答案 平衡不发生移动
已知在一定温度下SnO2(s) + 2H2(g)

Sn(s) + 2H2O(g) K1θ= 21.0 CO(g) + H2O(g)

CO2(g) + H2(g) K2θ= 0.0340因此下列反应SnO2(s) + 2CO(g)

Sn(s) + 2CO2(g) 的K3θ值为
A 21.0
B 0.714
C 0.0243
D 21.1
答案 0.0243
已知:
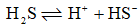
的
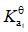
;
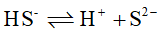
的
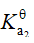
;
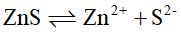
的
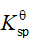
,则反应
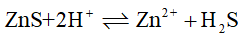
的
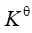
等于
A
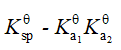
B
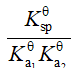
C
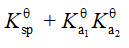
D
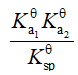
答案
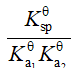
以下溶液稀释10倍时pH改变最大的是
A 0.1 mol/L NaAc-0.1 mol/L HAc溶液
B 0.1 mol/L NH4Ac-0.1 mol/L HAc溶液
C 0.1 mol/L NH4Ac溶液
D 0.1 mol/L NaAc溶液
答案 0.1 mol/L NH4Ac溶液
下表述中错误的是
A H2O作为酸的共轭碱是OH-
B H2O作为碱的共轭酸是H3O+
C 因为HAc的酸性强,故HAc的碱性必弱
D HAc的碱性弱,则H2Ac+的酸性强
答案 C
在水溶液中共轭酸碱对Ka与Kb的关系是
A Ka·Kb=1
B Ka·Kb=Kw
C Ka/Kb=Kw
D Kb/Ka=Kw
答案 Ka·Kb=Kw
影响平衡常数的因素是
A 反应物和产物的浓度
B 溶液的酸度
C 温度
D 催化剂
答案 温度
用NaOH溶液滴定H3PO4溶液至pH = 4.7时,溶液的简化质子条件为 (H3PO4的pKa1~pKa3分别是2.7.12.36)
A [H3PO4] = [H2PO4-]
B [H2PO4-] = [HPO42-]
C [H3PO4] = [HPO42-]
D [H3PO4] = 2[PO43-]
答案 [H3PO4] = [HPO42-]
右图是HAc的分布曲线,可以看出
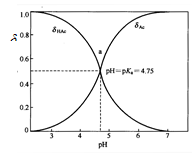
A pH=6.0时溶液中HAc为主要的存在形式
B 在两条曲线交点处 [HAc]= [Ac-]
C pH=3.0时溶液中Ac-为主要的存在形式
D 随着pH值的增大,溶液中的主要存在形式由Ac-变为HAc
答案 在两条曲线交点处 [HAc]= [Ac-]
对 于 酸 碱 指 示 剂, 全 面 而 正 确 的 说 法 是
A 指 示 剂 为 有 色 物 质
B 指 示 剂 为 弱 酸 或 弱 碱
C 指 示 剂 为 弱 酸 或 弱 碱, 其 酸 式 或 碱 式 结 构 具 有 不 同 颜 色
D 指 示 剂 在 酸 碱 溶 液 中 呈 现 不 同 颜 色
答案 指示剂为弱酸或弱碱,其酸式或碱式结构具有不同颜色
达到滴定终点时,酸碱指示剂呈现的是其酸式和碱式的中间色
A 对
B 错
答案 ×
为提高滴定分析的准确度,对标准溶液不必做到
A 正确地配制
B 准确地标定
C 对有些标准溶液须妥善保存
D 所有标准溶液必须当天配,当天标定,当天用
答案 所有标准溶液必须当天配,当天标定,当天用
用于滴定分析法的化学反应必须
A 定量完成
B 速度快
C 有确定终点的方法
D 三者皆是
答案 定量完成 :
(1) 反应定量地完成,即反应按一定的反应式进行,无副反应发生,而且进行完全(99.9%),这是定量计算的基础。
(2) 反应速率要快。对于速率慢的反应,应采取适当措施提高其反应速率。
(3) 能用较简便的方法确定滴定终点。
凡是能满足上述要求的反应,都可以用于直接滴定法中,即用标准溶液直接滴定被测物质。
滴定度=0.005585g/mL,其含义为
A 1mLK2Cr2O7相当于0.005585gFe
B 1mLK2Cr2O7溶液的质量为0.005585g
C 1mLK2Cr2O7溶液中含有0.005585gK2Cr2O7
D 1mL含Fe试液相当于0.005585gK2Cr2O7
答案 1mLK2Cr2O7相当于0.005585gFe
下列电对中,标准电极电势(jq)最大的是
A Ag+/Ag
B [Ag(NH3)2]+/Ag
C AgI/Ag
D AgBr/Ag
答案Ag+/Ag
AgI/Ag
下列电对中,若H+ 浓度增大,哪种电对的电极电势增大?
A Cl2/ Cl-
B AgBr/Ag
C Fe(OH)3/Fe(OH)2
D PbSO4/Pb
答案 ×
已知1mol·L-1HCl介质中
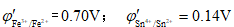
,则不能共存于同一溶液中的一对离子是
A Sn4+,Fe2+
B Fe3+,Sn2+
C Fe3+,Fe2+
D Sn4+,Sn2+
答:Fe3+,Sn2+
氧化还原反应的实质是2个电对之间的质子转移
A 对
B 错
答案 错
在电极反应中,因副反应的发生,使离子浓度变小,导致电极电势变小
A 对
B 错
答:错误
纷趟揪眉灯锑慰鸵坡剿庞谱填
划烘玻椭类鞍谷刚侗技插然际