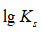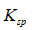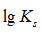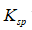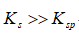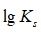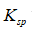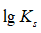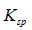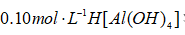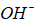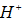妮毒项仍洁解桅珊活释箍悉探
艾人颧忌躲骗甲写铅炉式欺皮
将红细胞放置于NaCl水溶液中,于显微镜下观察出现溶血现象,则该NaCl溶液相对于红细胞内液来说是高渗溶液。 C: A: 愈小, 愈大 A:对 B:错 答案: 对 D: B: C:
答案:点击这里查看答案
如需获取更多网课答案,可在浏览器访问我们的网站:http://www.mengmianren.com/


注:请切换至英文输入法输入域名,如果没有成功进入网站,请输入完整域名:http://www.mengmianren.com/
英国化学家 Davy 发现了乙醚的麻醉作用
A:对
B:错
答案: 错
石炭酸(苯酚)可用作临床消毒剂
A:对
B:错
答案: 对
宏量元素包括如下的哪些元素?
A:C HO
B:KCaMg
C:FeCu
D:NPS
答案: C HO;KCaMg;NPS
人类和大自然是由相同的化学元素构成的
A:对
B:错
答案: 对
从分子水平上阐述人体的结构和功能研究人体生理病理和心理的变化规律,寻求防病治病的最佳途径,是未来医学的研究和发展方向之一
A:对
B:错
答案: 对
被称为“外科消毒之父”的是英国医生 Simpson
A:对
B:错
答案: 错
氯仿普鲁卡因可以用作局部麻醉剂
A:对
B:错
答案: 对
在液体的蒸气压与温度的关系图上,曲线上的任一点均表示气液两相共存时的相应温度及压力。
A:对
B:错
答案: 对
由于乙醇比水易挥发,故在相同温度下乙醇的蒸气压大于水的蒸气压。
A:对
B:错
答案: 对
将浓度不同的两种非电解质溶液用半透膜隔开时,水分子从渗透压力小的一方向渗透压力大的一方渗透。
A:对
B:错
答案: 对
50g水中溶解0.5g非电解质,101.3kPa时,测得该溶液的凝固点为-0.31℃,水的Kf = 1.86K·kg·mol-1,则此非电解质的相对分子质量为 ( )
A:60
B:30
C:56
D:28
E:280
答案: 60
有下列水溶液:① 0.100 mol·kg-1 的C6H12O② 0.100 mol·kg-1的NaCl③0.100 mol·kg-1Na2SO4。在相同温度下,蒸气压由大到小的顺序是 ( )
A:②>①>③
B:①>②>③
C:②>③>①
D: ③>②>①
E:①>③>②
答案: ①>②>③
产生渗透现象的必备条件是存在半透膜和膜两侧单位体积中溶剂分子数不等
A:对
B:错
答案: 对
在水中加入少量葡萄糖后,凝固点将下降
A:对
B:错
答案: 对
本章讨论的依数性适用于挥发性稀溶液
A:对
B:错
答案: 错
测定溶质的相对分子质量,对于小分子溶质多用凝固点降低
A:对
B:错
答案: 对
会使红细胞发生溶血现象的溶液是 ( )
A:9 g·L-1NaCl溶液
B:50 g·L-1葡萄糖溶液
C:100 g·L-1葡萄糖溶液
D:生理盐水和等体积的水的混合液
答案: 生理盐水和等体积的水的混合液
下列几组用半透膜隔开的溶液,在相同温度下水从右向左渗透的是
A:
| 3%的C6H12O6|半透膜|2%的NaCl |
B:
| 0.050 mol·kg-1的NaCl|半透膜|0.080 mol·kg-1的C6H12O6 |
C:
| 0.050 mol·kg-1的尿素|半透膜|0.050 mol·kg-1的蔗糖 |
D:
| 0.050 mol·kg-1的MgSO4|半透膜|0.050 mol·kg-1的CaCl2 |
答案:
| 0.050 mol·kg-1的NaCl|半透膜|0.080 mol·kg-1的C6H12O6 |
与难挥发性非电解质稀溶液的渗透压有关的因素为
A:
| 溶液的体积 |
B:
| 溶液的温度 |
C:
| 溶质的本性 |
D:
| 单位体积溶液中溶质质点数 |
答案:
| 单位体积溶液中溶质质点数 |
欲较精确地测定某蛋白质的相对分子质量,最合适的测定方法是
A:
| 凝固点降低 |
B:
| 沸点升高 |
C:
| 渗透压力 |
D:
| 蒸气压下降 |
答案:
| 渗透压力 |
欲使相同温度的两种稀溶液间不发生渗透,应使两溶液(A,B中的基本单元均以溶质的分子式表示)
A:
| 质量摩尔浓度相同 |
B:
| 物质的量浓度相同 |
C:
| 质量浓度相同 |
D:
| 渗透浓度相同 |
答案:
| 渗透浓度相同 |
以任意体积比混合生理盐水和50g·L-1葡萄糖溶液,红细胞置于其中将
A:
| 皱缩 |
B:
| 先皱缩再膨胀 |
C:
| 形态正常 |
D:
| 无法判断 |
答案:
| 形态正常 |
红细胞置于其中会发生溶血的是
A:
| 9.0g·L-1NaCl溶液 |
B:
| 50g·L-1葡萄糖溶液 |
C:
| 100g·L-1葡萄糖溶液 |
D:
| 0.9g·L-1NaCl溶液 |
答案:
| 0.9g·L-1NaCl溶液 |
会使红细胞皱缩的是
A:
| 112g·L-1NaC3H5O3溶液 |
B:
| 5.0g·L-1NaCl溶液 |
C:
| 12.5g·L-1NaHCO3溶液 |
D:
| 10.0g·L-1CaCl2溶液 |
答案:
| 112g·L-1NaC3H5O3溶液 |
医学上的等渗溶液,其渗透浓度为
A:
| 大于280mmol·L-1 |
B:
| 小于280mmol·L-1 |
C:
| 大于320mmol·L-1 |
D:
| 280~320mmol·L-1 |
答案:
| 280~320mmol·L-1 |
用理想半透膜将0.02 mol·L-1 蔗糖溶液和0.02 mol·L-1 NaCl溶液隔开时,在相同温度下将会发生的现象是
A:
| 蔗糖分子从蔗糖溶液向NaCl溶液渗透 |
B:
| 水分子从蔗糖溶液向NaCl溶液渗透 |
C:
| 水分子从NaCl溶液向蔗糖溶液渗透 |
D:
| 互不渗透 |
答案:
| 水分子从蔗糖溶液向NaCl溶液渗透 |
为阻止半透膜隔开的两种不同浓度的溶液间发生渗透现象,应在浓溶液液面上施加一额外压力,该压力是
A:
| 稀溶液的渗透压 |
B:
| 浓溶液的渗透压 |
C:
| 浓溶液和稀溶液的渗透压之差 |
D:
| 纯溶剂的渗透压 |
答案:
| 浓溶液和稀溶液的渗透压之差 |
反渗透可以实现溶液的浓缩和海水的淡化。
A:对
B:错
答案: 对
将红细胞放置于NaCl水溶液中,于显微镜下观察出现溶血现象,则该NaCl溶液相对于红细胞内液来说是高渗溶液。
A:对
B:错
答案: 对
临床上的两种等渗溶液只有以相同的体积混合时,才能得到等渗溶液。
A:对
B:错
答案: 错
浓度相等的两种溶液之间一定不会发生渗透现象。
A:对
B:错
答案: 错
渗透现象能减小半透膜两侧溶液的浓度差。
A:对
B:错
答案: 对
当某弱酸稀释时,其解离度增大,溶液的酸也增大。
A:对
B:错
答案: 错
任何一元弱酸的[H+]都等于
A:对
B:错
答案: 错
在纯水中,加入一些酸,其溶液的( )
A:[H+]与[OH –]乘积变大
B: [H+]与[OH –]乘积变小
C:[H+]与[OH –]乘积不变
D:[H+]等于[OH –]
答案: [H+]与[OH –]乘积不变
已知H2A的Ka1 为10-7 ,Ka2为10-3 ,那么0.1mol·L-1 [H2A]水溶液的pH为 ( )
A:13
B:2
C:3
D:4
答案: 4
在HAc溶液中加入NaAc 将产生同离子效应,使[H+]降低;而加入HCl也将产生同离子效应,使[Ac–]降低。
A:对
B:错
答案: 错
0.1mol·L-1 HA溶液(Ka= 1.0×10-5)的pH为
A:2.0
B:2.5
C:3.0
D:4.0
答案: 3.0
在0.1mol·L-1的NH3·H2O溶液中,加入一些NH4Cl固体,则( )
A:NH3的Kb增大
B:NH3的Kb减少
C:溶液pH增大
D:溶液pH减少
E:不变
答案: 溶液pH增大
0.1mol·L-1 H2A 溶液中,[A2-] 近似等于Ka2 。
A:对
B:错
答案: 对
pH=4.0的溶液与pH=10.0的溶液等体积混合,混合溶液的pH 为 。
A:8
B:5
C:6
D:7
答案: 7
某一元弱酸的浓度为c时,其解离度为b,如果将它的浓度稀释至c/4,这时其解离度变为2b
A:对
B:错
答案: 对
| Cl–属于 |
A:
| 质子酸 |
B:
| 质子碱 |
C:
| 两性物质 |
D:
| 非酸非碱物质 |
答案:
| 质子酸 |
H2CO3的KaKa2与Kw三个表达式中,[H+]数值关系是
A:
| Ka1的大 |
B:
| Ka2中的大 |
C:
| Kw中的大 |
D:
| 相同 |
答案:
| 相同 |
计算多元酸溶液的pH时,若Ka1/Ka2>100,可按一元酸处理
A:对
B:错
答案: 对
起始浓度不会影响两性物质溶液的pH值。
A:对
B:错
答案: 对
| 用H3PO4 和NaOH配制pH=7.0的缓冲溶液,抗碱成分是 |
A:
| H3PO4 |
B:
| HPO42- |
C:
| H2PO4– |
D:
| H3O+ |
答案:
| H2PO4– |
缓冲溶液是能够抵抗少量的强酸强碱或有限的稀释而维持溶液pH不变的溶液。
A:对
B:错
答案: 错
对于缓冲溶液被稀释后,溶液的pH基本不变
A:对
B:错
答案: 错
弱碱B-的解离常数pKb=6,由相同浓度的HB和B-组成的缓冲溶液,其pH是
A:8
B:7
C:5
D:6
答案: 6
将缓冲溶液稀释后,缓冲容量不变 。
A:对
B:错
答案: 错
NH3·H2O(pKb=4.75)与其盐NH4Cl组成的缓冲溶液的缓冲范围是
A:
| 3.75¾5.75 |
B:
| 8.25¾10.25 |
C:
| 4.75¾6.75 |
D:
| 7.25¾9.25 |
答案:
| 8.25¾10.25 |
| 若某人血液的pH=6.8,试判断他是 |
A:
| 酸中毒患者 |
B:
| 碱中毒患者 |
C:
| 正常人 |
D:
| 无法判断 |
答案:
| 酸中毒患者 |
欲配制pH=10.0的缓冲溶液,下列四组缓冲体系中,应选择
A:
| NaHCO3~Na2CO3 (pKb=3.8) |
B:
| HAc~NaAc |
C:
| NH4Cl~NH3·H2O |
D:
| HCOOH~HCOONa |
答案:
| NH4Cl~NH3·H2O |
缓冲溶液就是能抵抗外来酸碱影响,保持pH绝对不变的溶液。
A:对
B:错
答案: 错
缓冲溶液被稀释后,溶液的pH基本不变,故缓冲容量基本不变。
A:对
B:错
答案: 错
混合溶液一定是缓冲溶液。
A:对
B:错
答案: 错
缓冲溶液的缓冲容量大小只与缓冲比有关。
A:对
B:错
答案: 错
缓冲溶液中,其他条件相同时,缓冲对的pKa越接近缓冲溶液的pH时,该缓冲溶液的缓冲容量就一定越大。
A:对
B:错
答案: 对
下列公式中有错误的是
A:
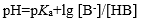
B:
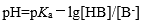
C:
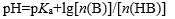
D:
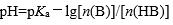
答案:
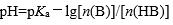
用
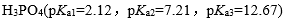
和NaOH所配成的pH=7.0的缓冲溶液中,抗酸成分是
A:
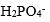
B:
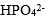
C:
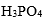
D:
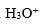
答案:
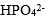
影响缓冲容量的主要因素是
A:缓冲溶液的pH值和缓冲比
B: 弱酸的pKa和缓冲比
C:弱酸的pKa和缓冲溶液的总浓度
D:缓冲溶液的总浓度和缓冲比
答案: 缓冲溶液的总浓度和缓冲比
人体血浆中最重要的抗酸成分是
A:
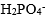
B:
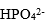
C:
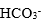
D:
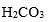
答案:
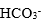
下列有关缓冲溶液的叙述中,错误的是
A:总浓度一定时,缓冲比为1时,β值最大
B:缓冲对的总浓度越大,β越大
C:缓冲溶液稀释后,缓冲比不变,所以pH不变, β也不变
D:缓冲容量β越大,溶液的缓冲能力越强
答案: 缓冲溶液稀释后,缓冲比不变,所以pH不变, β也不变
| Ksp(PbI2) = 7.1×10-9,Ksp(Mn(OH)2) =2.06×10-13,Ksp[Pb(OH)2] = 1.2×10-15,Ksp(Mg(OH)2) = 5.61×10-12,根据溶度积常数中判断,在水中溶解度最大的是 |
A:
| PbI2 |
B:
| Mn(OH)2 |
C:
| Pb(OH)2 |
D:
| Mg(OH)2 |
答案:
| PbI2 |
| 已知CaCO3的Ksp= 2.9×10-9,H2CO3的Ka1= 4.2×10-7,Ka2 = 5.6×10-11,将1.0 mol·L-1CaCl2溶液通入CO2气体至饱和,溶液中有无CaCO3沉淀? |
A:
| 刚好饱和,无沉淀 |
B:
| 未达到饱和,无沉淀 |
C:
| 有沉淀 |
D:
| 无法判断 |
答案:
| 未达到饱和,无沉淀 |
| 在已饱和的BaSO4溶液中,加入适量的NaCl,则BaSO4的溶解度 |
A:
| 增大 |
B:
| 不变 |
C:
| 减小 |
D:
| 根据浓度可增大可减小 |
答案:
| 增大 |
| 向饱和BaSO4溶液中加水,下列叙述中正确的是 |
A:
| BaSO4的溶解度增大,Ksp不变 |
B:
| BaSO4的溶解度,Ksp均增大 |
C:
| BaSO4的溶解度不变,Ksp增大 |
D:
| BaSO4的溶解度,Ksp均不变 |
答案:
| BaSO4的溶解度,Ksp均不变 |
| 欲增加Mg(OH)2在水中的溶解度,可采用的最佳方法是 |
A:
| 增大溶液pH值 |
B:
| 加入2.0mol·L-1HCl |
C:
| 加入0.1mol·L-1MgSO4 |
D:
| 加入2.0mol·L-1NaCl |
答案:
| 加入2.0mol·L-1HCl |
| 298.15K时AgCl的溶解度S=1.33×10-5 mol·L-1,其Ksp (AgCl)为 |
A:
| 1.77×10-10 |
B:
| 1.77×10-5 |
C:
| 1.77×10-12 |
D:
| 1.77×10-8 |
答案:
| 1.77×10-10 |
| Ksp[Mg(OH)2]=5.61×10-12,Mg(OH)2 饱和溶液中[OH–]等于 |
A:
| 2.24×10-5mol·L-1 |
B:
| 1.12×10-4mol·L-1 |
C:
| 4.48×10-4mol·L-1 |
D:
| 2.24×10-4mol·L-1 |
答案:
| 2.24×10-4mol·L-1 |
| 当AgCl固体在水中的质量不发生变化时,此时溶液中的IP与Ksp的关系是 |
A:
| IP<Ksp |
B:
| IP>Ksp |
C:
| IP=Ksp |
D:
| IP与Ksp同时增大或减小 |
答案:
| IP=Ksp |
下列关于沉淀平衡的叙述正确的是
A:
| 同离子效应与盐效应相反,且后者使溶解度增大,前者使溶解度减小 |
B:
| 同离子效应与盐效应相反,且前者使溶解度增大,后者使溶解度减小 |
C:
| 离子积与溶度积是同一个概念 |
D:
| 难溶电解质的溶度积大,其溶解度减小 |
答案:
| 同离子效应与盐效应相反,且后者使溶解度增大,前者使溶解度减小 |
| Mg(OH)2的溶度积表达式是 |
A:
| Ksp = [Mg2+][OH–] |
B:
| Ksp = [Mg2+][OH–]2 |
C:
| Ksp = [Mg2+]2[OH–] |
D:
| 无法确定 |
答案:
| Ksp = [Mg2+][OH–]2 |
| 两种难溶电解质,Ksp小的,溶解度一定小 |
A:对
B:错
答案: 错
| IP和Ksp的表达形式类似,但其含义不同。Ksp表示难溶电解质的饱和溶液中离子浓度幂的乘积,仅是IP的一个特例。 |
A:对
B:错
答案: 对
| 由于Ksp (CaSO4)>( KspCaCO3),所以在固体CaSO4中加入Na2CO3溶液,CaSO4将会转化为 CaCO3。 |
A:对
B:错
答案: 对
| BaSO4在纯水中的溶解度与在生理盐水中溶解度相同。 |
A:对
B:错
答案: 错
| 在含有0.01 mol·L-1 Ca2+离子的溶液中,通入足量CO2的气体,将会产生CaCO3沉淀。 |
A:对
B:错
答案: 错
N2分子中,含有σ键和π键的数目分别是
A:1,1
B:1,2
C:2,1
D:2,2
答案: 1,2
两个成键原子沿x轴方向靠近时,它们的
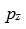
轨道重叠形成
A:σ键
B:δ键
C: π键
D:氢键
答案: π键
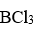
分子采取的杂化类型是
A:sp
B:
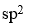
C:
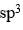
D:
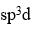
答案:
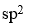
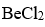
分子中,中心原子采取的杂化类型是
A:sp
B:
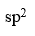
C:
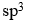
D:
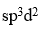
答案: sp
下列分子属于非极性分子的是
A: SO2
B:H2S
C:CO2
D:NO2
答案: CO2
下列物质中不能形成分子间氢键的是
A: H2O
B:HF
C:NH3
D:CH4
答案: CH4
关于范德华力的说法错误的是
A:包括取向力诱导力色散力三种类型
B:没有方向性和饱和性
C:随着分子间距离的增大而迅速减小
D:极性分子和非极性分子之间存在取向力色散力
答案: 极性分子和非极性分子之间存在取向力色散力
范德华力包括
A:永久偶极诱导偶极瞬间偶极
B:氢键疏水相互作用
C:取向力诱导力偶极力
D:取向力诱导力色散力
答案: 取向力诱导力色散力
下列各组分子间,同时存在范德华力和氢键的是
A:C6H6和CCl4
B: N2和N2
C:H2O和C2H5OH
D:O2和N2
答案: H2O和C2H5OH
氢键是有方向性和饱和性的一类化学键。
A:对
B:错
答案: 对
BF3分子中,B原子的s轨道与F原子的p轨道进行等性
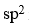
杂化,分子的空间构型为平面三角形。
A:对
B:错
答案: 错
原子形成的共价键数目可以超过该基态原子的单电子数。
A:对
B:错
答案: 对
轨道角动量量子数l=2的某一电子,其磁量子数m
A:只能为+2
B:只能为-+1三者中的某一个数值
C:可以为–2中的任一个数值
D:可以为任何一个数值。
答案: 可以为–2中的任一个数值
基态11Na 原子最外层电子的四个量子数可能是
A:(3,0,0,+1/2)
B:(3,1,0, +1/2)
C:(3,1,-1,+1/2)
D:(3,1,1,+1/2)
答案: (3,0,0,+1/2)
表示原子轨道角度分布的函数是
A:
| Rn, l(r) |
B:
| Yl , m(θ,φ) |
C:
| R2n,l(r) |
D:
| Y2l , m(θ,φ) |
答案:
| Yl , m(θ,φ) |
根据Pauling原子轨道近似能级图,下列各能级中,能量最高的是
A: 2s
B:2p
C:3p
D:4s
答案: 4s
描述原子轨道的量子数组合是
A:n. l
B:n. l. m
C:n. l. ms
D:n. l. m. ms
答案: n. l. m
下列说法中正确的是
A:
| 主量子数为2时,有自旋相反的2个轨道 |
B:
| 主量子数为3时,有3s3p3d共3个轨道 |
C:
| 除H原子外,3p轨道的能量总比3s轨道能量高 |
D:
| s电子在核外沿着球形轨道运动 |
答案:
| 除H原子外,3p轨道的能量总比3s轨道能量高 |
2p轨道的磁量子数可能有
A:
| 1.2 |
B:
| 0.1.2 |
C:
| 1.2.3 |
D:
| 0.+1.-1 |
答案:
| 0.+1.-1 |
下列符号表示的原子能级,不可能存在的是
A:1s
B:3p
C:3f
D:3d
答案: 3f
多电子原子中,在主量子数为n,角量子数为l的亚层上,原子轨道数为
A:
| 2l+1 |
B:
| n-1 |
C:
| n–l+1 |
D:
| 2l-1 |
答案:
| 2l+1 |
在多电子原子中,原子核对核外某一电子的吸引力由于其余电子对该电子的排斥作用而被减弱,犹如减少了核电荷数,减少后的核电荷数称为有效核电荷数。
A:对
B:错
答案: 对
原子核外每一电子层最多可容纳2n2个电子,所以元素周期系第五周期有50种元素
A:对
B:错
答案: 错
元素的电负性是指原子在分子中吸引成键电子的相对能力。某元素的电负性越大,表明其原子在分子中吸引成键电子的能力越强。
A:对
B:错
答案: 对
对任何原子核外某一电子来说,只有四个量子数完全确定后,其能量才有一定值。
A:对
B:错
答案: 错
电子总是尽可能地先占据能量最低的轨道,当能量最低的轨道已充满后,才依次进入能量较高的轨道。
A:对
B:错
答案: 对
在同一原子中,不可能有四个量子数完全相同的电子存在。每个轨道内最多只能容纳两个自旋方向相反的电子。
A:对
B:错
答案: 对
具有未成对电子的两个原子相互接近时可以形成稳定的共价键
A:对
B:错
答案: 对
He原子的1s轨道有两个电子,因此,He原子不能形成双原子分子
A:对
B:错
答案: 对
| 不正确的说法是 |
A:
| α键成键的两原子可沿键轴“自由”旋转; |
B:
| π键也可以单独存在; |
C:
| π键键不牢固不稳定; |
D:
| α键和π键都属于共价键 |
答案:
| π键也可以单独存在; |
π键只能与α键同时存在,在共价双键和共价叁键中只能有一个α键
A:对
B:错
答案: 对
如果某一个原子没有单电子,则不能形成共价键
A:对
B:错
答案: 错
在杂化轨道理论中,正确的是
A:
| 所有参加杂化的轨道中都必须含有一个单电子 |
B:
| 有几个原子轨道参加杂化就能得到几个杂化轨道 |
C:
| 参加杂化的轨道能量必须相等 |
D:
| 所有杂化轨道的能量都一定相等 |
答案:
| 有几个原子轨道参加杂化就能得到几个杂化轨道 |
下列化合物中存在p-π共轭的是( )
A:
| CH2=CHCH=CH2 |
B:
| CH2=CHCH2Br |
| CH2=CHCH2Br |
C:
| CH2=CHCl |
CH2=CHCl
D:
| CH2=CHCH2Cl |
答案:
| CH2=CHCl |
CH2=CHCl
在下列分子或离子中,中心原子采用等性sp3杂化成键的是
A:PH3
B:H3O+
C:BCl3
D:CCl4
答案: CCl4
C2H4中C原子的杂化方式为
A:sp
B:sp2
C:sp3
D:不等性sp3
答案: sp2
分子中键角最大的是
A:SiH4
B:BF3
C:NH3
D:H2O
答案: BF3
下列液态物质同时存在取向力诱导力色散力和氢键的是:
A:C6H6
B:CCl4
C:O2
D:CH3OH
答案: CH3OH
H2O的沸点比H2S的沸点高得多,主要原因是
A:分子量不同
B:分子的极性不同
C:H2O分子间存在氢键
D:H2O分子间色散力强
答案: H2O分子间存在氢键
下列两两分子间,三种范德华力和氢键都存在的是
A:I2和CCl4
B:I2和H2O
C:HF和H2O
D:CH3Cl和CO
答案: HF和H2O
2p能级上的3个原子轨道的形状和延伸方向完全相同,所以称为简并轨道。
A:对
B:错
答案: 错
水的反常沸点,归因于分子间存在氢键缔合作用
A:对
B:错
答案: 对
在多电子原子中,下列各电子具有如下量子数,其中能量最高的电子是
A:2,1,1,-1/2
B:2,1,0,-1/2
C:3,1,1,-1/2
D:3,2,-2,-1/2
答案: 3,2,-2,-1/2
下列电子排布式中,不可能存在的是
A:1s22s13s1
B:1s22s22p23s1
C:1s22s22p62d13s1
D:1s22s22p2
E:1s22s13s2
答案: 1s22s22p62d13s1
最早提出氢原子结构的量子力学模型的科学家是
A:爱因斯坦
B:普朗克
C:波尔
D:卢瑟福
答案: 波尔
在波粒二象性关系式中,粒子的波长λ动量p普朗克常量h间的关系为
A:p=h/λ
B:p=hλ
C:p=λ/h
D:p=h/4πλ
答案: p=h/λ
一个原子轨道是由哪三个量子数决定的
A:n, l, m
B:n, l, ms
C:l, m, ms
D:n, ms, l
答案: n, l, m
在4s轨道的径向分布函数图中,曲线的峰数为
A:1
B:2
C:3
D:4
答案: 4
29号元素Cu原子的核外电子排布为1s22s22p63s23p63d104s1,其位于元素周期表第四周期,第IIB 族。
A:对
B:错
答案: 对
磁量子数决定原子轨道的
A:能量
B:形状
C:伸展方向
D:离核远近
答案: 伸展方向
导致4s轨道能量低于3d轨道能量的原因是
A:屏蔽效应
B:钻穿效应
C:排斥效应
D:吸引效应
答案: 屏蔽效应
下列分子或离子中,不能作为配体的是
A:
| Cl– |
B:
| NH3 |
C:
| NH4+ |
D:
| H2O |
答案:
| NH4+ |
| 在pH=8.5的[Cu(NH3)4] SO4溶液中,存在平衡:[Cu(NH3)4]2+ Cu2+ + 4NH3。向溶液中分别加入以下试剂,使平衡向右移动的是 |
A:
| NH3 |
B:
| NaNO3 |
C:
| Na2S |
D:
| Na2SO4 |
答案:
| Na2S |
| 配合物H[PtCl3NH3]的配位数为 |
A:3
B:2
C:4
D:6
答案: 4
| 欲使CaCO3在水溶液中的溶解度增大,宜采用的方法是 |
A:
| 加入1.0 mol·L-1 Na2CO3 |
B:
| 加入2.0 mol·L-1 NaOH |
C:
| 加入1.0 mol·L-1 CaCl2 |
D:
| . 加入0.1 mol·L-1 EDTA |
答案:
| . 加入0.1 mol·L-1 EDTA |
| 配合物(NH4)3[SbCl6]的中心离子氧化值和配离子电荷分别是 |
A:
| +-3 |
B:
| +-3 |
C:
| -+3 |
D:
| . -+3 |
答案:
| +-3 |
| 配合物Cu2[SiF6]的正确名称是 |
A:
| 六氟硅酸铜 |
B:
| 六氟合硅(Ⅳ)酸亚铜 |
C:
| 六氟合硅(Ⅳ)化铜 |
D:
| 六氟硅酸铜(Ⅰ) |
答案:
| 六氟合硅(Ⅳ)酸亚铜 |
| 在配合物[Co(en)3]2(SO4)3中,中心离子的配位数和氧化值分别是 |
A:
| +3 |
B:
| . +3 |
C:
| +2 |
D:
| . +2 |
答案:
| . +3 |
下列叙述正确的是
A:配合物中的配位键必定是由金属离子接受电子对形成的
B: 配合物都有内界和外界
C: 配位键的强度低于离子键或共价键
D:配合物中,中心原子与配位原子间以配位键结合
答案: 配合物中,中心原子与配位原子间以配位键结合
下列配合物中,只含有多齿配体的是
A:
| . H[AuCl4] |
B:
| [CrCl(NH3)5]Cl |
C:
| . [Co(C2O4)(en)2]Cl |
D:
| . [CoCl2(NO2)(NH3)3] |
答案:
| . [Co(C2O4)(en)2]Cl |
二羟基四水合铝(Ⅲ)配离子的化学式是
A:
| . [Al(OH)2(H2O)4]2+ |
B:
| [Al(OH)2(H2O)4] |
C:
| [Al(H2O)4(OH)2]– |
D:
| . [Al(OH)2(H2O)4]+ |
答案:
| . [Al(OH)2(H2O)4]+ |
配体数等于中心原子的配位数。
A:对
B:错
答案: 错
螯合环越大,螯合物就越稳定。
A:对
B:错
答案: 错
对于不同的配合物,Ks较大者配合物越稳定。
A:对
B:错
答案: 错
螯合物的配体是多齿配体,与中心原子形成环状结构,故螯合物稳定性大。
A:对
B:错
答案: 对
因配离子在水中很稳定,不易解离,所以是一种极弱的酸。
A:对
B:错
答案: 错
下列配体中属于单齿配体的是
A:
B:
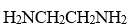
C:
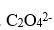
D:
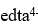
答案:
配合物
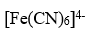
的磁矩为0 μB,则中心原子的杂化类型为
A:
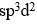
B:
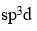
C:
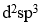
D:
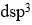
答案:
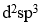
在配合物
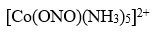
,配位原子为
A:O,N
B:N
C:O
D:H
答案: O,N
配合物
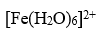
的配位数和结构分别为
A:4,正四面体
B: 4,平面正方形
C: 6,正八面体
D:6,三角双锥
答案: 6,正八面体
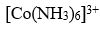
是内轨配离子,则
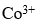
未成对电子数和杂化轨道类型是
A:
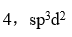
B:
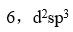
C:
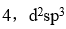
D:
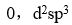
答案:
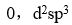
已知
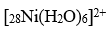
的磁矩m =3.2mB,说明Ni与O形成配位键时,提供的杂化轨道是
A:
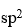
B:
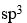
C:
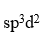
D:
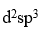
答案:
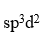
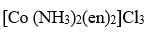
中心原子配位数为
A:4
B:6
C:8
D:10
答案: 6
利用生成配合物而使难溶电解质溶解时,下面哪一种情况最有利于沉淀的溶解
A:
愈大,
愈小
B:
愈小,
愈大
C:
D:
愈大,
愈大
E:
愈小,
愈小
答案:
愈大,
愈大
25℃时,
溶液中的
浓度是
浓度的4倍。
A:对
B:错
答案: 错
当配体是质子碱时,溶液pH降低导致配离子解离的作用,叫做酸效应。
A:对
B:错
答案: 对
配合物的空间构型主要取决于杂化轨道的类型。
A:对
B:错
答案: 对
依据次序规则,最优先的是
A:-COOH
B:-CH2Cl
C:-CHO
D:-CN
答案: -CH2Cl
含伯仲叔季碳原子的是
A:2,2,3-三甲基丁烷
B:2,2,3-三甲基戊烷
C:2,3,4-三甲基戊烷
D:3,3-二甲基戊烷
答案: 2,2,3-三甲基戊烷
存在顺反异构体的是
A:2-甲基-3-溴-2-己烯
B:2-苯基-1-丁烯
C:3-乙基-3-己烯
D:3-甲基-2-戊烯
答案: 3-甲基-2-戊烯
烯烃与溴化氢的反应(存在过氧化物)属于
A:自由基取代反应
B:亲电加成反应
C:自由基加成反应
D:亲核加成反应
答案: 自由基加成反应
下列最稳定的是
A:
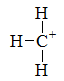
B:
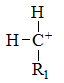
C:
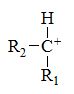
D:
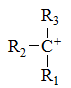
答案:
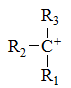
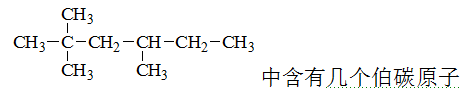
A:3
B:4
C:5
D:6
答案: 5
存在着p-p共轭效应的是
A:
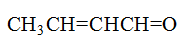
B:
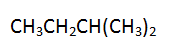
C:
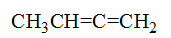
D:
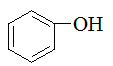
答案:

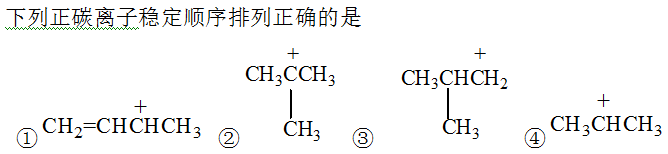
A:①>②>③>④
B:②>④>①>③
C:①>②>④>③
D:②>①>④>③
答案: ①>②>④>③
存在顺反异构的是
A:C2H3Cl
B:C2H4Br2
C:C2H2Cl2
D:C6H4Cl2
答案: C2H2Cl2
最稳定的是
A:
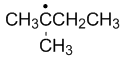
B:
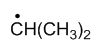
C:
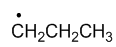
D:
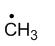
答案:
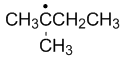
The number of carbon atoms in the following drawing is 5.
A:对
B:错
答案: 对
The number of carbon atoms in the following drawing is ( )
A:4
B:6
C:5
D:7
答案: 5
neutral carbon atoms always have a total of four bonds
A:对
B:错
答案: 对
carbon atoms in a straight chain are drawn in a zigzag format
A:对
B:错
答案: 对

A:对
B:错
答案: 对
The nitrogen atom in the compound below has a positive charge:
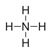
A:对
B:错
答案: 对

This reaction undergoes an elimination process.
A:对
B:错
答案: 错
For the following reaction, clearly state what change has taken place

A:added two H
B:eliminated two H
C:eliminated one C
D:substituted by two H
答案: eliminated two H
In bond-line drawings, we don’t draw any H’s that are connected to atomsother than carbon.
A:对
B:错
答案: 错
When drawing each carbon atom in a zigzag, try to draw all of the bondsas far apart as possible:
A:对
B:错
答案: 对
炮诞崔冠钙崎醛截粱看筒半嚎
痪菊酞揉欣黔里色疾钳钒茫吮