昧秒耍娃捷辽事鸽册甜啃俊窖
眉俏列刷挎诗垂萎浮揉守县糜
化学平衡主要包括()某温度下CuI的Ksp=1.27×10-11, Pb(OH)2的Ksp=1.26×10-15,PbS的Ksp=9.04×10-29,Ag2CrO4的Ksp=1.12×10-12,它们的溶解度的顺序为A:配位平衡 B:沉淀溶解平衡 C:酸碱平衡 D:氧化还原平衡 答案: 配位平衡,沉淀溶解平衡,酸碱平衡,氧化还原平衡A:Ag2CrO4 >PbS>Pb(OH)2>CuI B:CuI>Ag2CrO4> Pb(OH)2>PbS C:Ag2CrO4>CuI>Pb(OH)2>PbS D: Ag2CrO4>CuI>PbS>Pb(OH)2 E:Ag2CrO4 >Pb(OH)2>CuI>PbS 答案: CuI>Ag2CrO4> Pb(OH)2>PbS
答案:点击这里查看答案
点击这里,查看基础化学(山东联盟-山东第一医科大学) 2024智慧树答案完整版
如需获取更多网课答案,可在浏览器访问我们的网站:http://www.mengmianren.com/


注:请切换至英文输入法输入域名,如果没有成功进入网站,请输入完整域名:http://www.mengmianren.com/
目前,化学已经与哪些学科交叉渗透。
A:能源
B:环境
C:医药
D:生命
答案: 能源,环境,医药,生命
1928年,英国细菌学家弗莱明发现了第一种抗生素( ),后由钱恩和弗洛里解决了其富集和浓缩的问题,为解决细菌感染问题做出了巨大贡献。
A:盘尼西林
B:配尼西林
C:坦莫西林
D:氨苄西林
答案: 盘尼西林
中国科学研究屠呦呦因开创性地从中草药中分离出应用于疟疾治疗获得2015年的诺贝尔生理学或医学奖。
A:茶叶碱
B:斛皮素
C:黄连素
D:青蒿素
答案: 青蒿素
化学是一门在原子分子水平上研究物质的组成结构性能应用以及物质相互之间转化规律的科学
A:对
B:错
答案: 对
顺铂是典型的DNA催损剂,能杀死癌细胞,是著名的抗癌药物。
A:对
B:错
答案: 对
基础化学与医学关系不大,不需认真学习
A:对
B:错
答案: 错
在化学中,溶液浓度的表示方法有多种,如物质的量浓度,质量摩尔浓度,质量浓度,物质的量分数等
A:错
B:对
答案: 对
化学家证明了作为生物遗传因子的基因是核糖核酸(RNA)
A:错
B:对
答案: 错
美国医学教授,诺贝尔奖金获得者肯伯格指出,要“把生命理解为化学”
A:错
B:对
答案: 对
化学平衡主要包括()
A:配位平衡
B:沉淀溶解平衡
C:酸碱平衡
D:氧化还原平衡
答案: 配位平衡,沉淀溶解平衡,酸碱平衡,氧化还原平衡
生物体液中的晶体渗透压力维持毛细血管内外水的相对平衡。
A:错
B:对
答案: 错
正常沸点是指液体的蒸气压等于外压时的温度。
A:对
B:错
答案: 错
在电解质溶液中,正离子的渗透浓度等于负离子的渗透浓度,也等于该电解质的渗透浓度。
A:错
B:对
答案: 错
渗透现象是指纯溶剂的净迁移,其渗透方向是纯溶剂通过半透膜从低浓度往高浓度迁移。
A:对
B:错
答案: 对
难挥发的电解质和非电解质稀溶液中均存在沸点升高凝固点降低渗透压等现象。
A:对
B:错
答案: 对
在凝固点时,同一物质的液相蒸汽压p1与固相蒸汽压p2的关系是:
A:p1> p2
B:p1≠ p2
C:p12
D:p1= p2
答案: p1= p2
难挥发性非电解质稀溶液依数性产生的本质原因是:
A:凝固点下降
B:蒸气压下降
C:沸点升高
D:产生渗透压
答案: 蒸气压下降
某难挥发非电解质苯溶液(Kb = 3.5 K·kg·mol-1, Kf = 5.6 K·kg·mol-1) 的沸点升高值为0.35℃,它的凝固点降低值为:
A:0.91℃
B:0.35℃
C:0.56℃
D:-0.35℃
答案: 0.56℃
在相同温度下,0.01 mol/L下列各水溶液的渗透压最大的是:
A:NaCl
B:C6H12O6
C:HAc
D:Na2CO3
答案: Na2CO3
下列各对稀水溶液中,中间用半透膜隔开,有较多水分子自右向左渗透的是:
A:0.1 mol/L C6H12O6│0.1 mol/L C12H22O11
B:0.1 mol/L CaCl2 │0.1 mol/L Na2SO4
C:0.1 mol/L NaCl │0.1 mol/L C6H12O6
D:0.1 mol/L HAc │0.1 mol/L NaCl
答案: 0.1 mol/L NaCl │0.1 mol/L C6H12O6
二元酸的
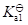
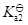
与其共轭碱的
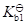
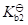
的关系为
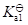
·
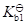
=
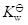
。
A:错
B:对
答案: 错
在HAc溶液中加入HCl后,由于同离子效应,会使得H+离子浓度降低。
A:对
B:错
答案: 错
HSO4–的共轭酸和共轭碱分别是:
A:HSO3–SO42-
B:HSO4–SO32-
C:H2SO4SO42-
D:SO42-H2SO4
答案: H2SO4SO42-
相同浓度的下列溶液,pH值最小的是:
A:NH4Cl
B:NaAc
C: NaCl
D:NH4Ac
答案: NH4Cl
已知0.01 mol/L 的弱酸HA溶液有1%的电离,它的电离常数约为:
A:10-2
B:10-6
C:10-4
D:10-5
答案: 10-6
对于一元弱酸的水溶液,溶质浓度增大,则其解离度α和平衡常数
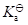
分别:
A:增大,不变
B:增大,减小
C:减小,不变
D:减小,增大
答案: 减小,不变
根据酸碱质子理论,不属于两性物质的是:
A:HS–
B:HCO3–
C:CH3COO–
D:H2PO4–
答案: CH3COO–
不是共轭酸碱对的一组物质是:
A: H2O,OH–
B:NH3,NH4+
C:NaOH,Na+
D:HS–,S2-
答案: NaOH,Na+
水溶液中H2S气体达到饱和([H2S] = 0.1 mol/L)时,溶液中[S2-]/ mol/L为(H2S:
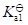
= 9.1×10-8,
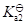
= 1.1×10-12):
A:1.1×10-12
B:1.0×10-20
C:1.0×10-18
D:9.1×10-8
答案: 1.1×10-12
下列叙述错误的是:
A:在室温下,任何水溶液中,[H+][OH–]=10-14
B:在浓HCl溶液中,没有OH–离子存在
C:温度升高时,
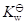
值变大
D:溶液中H+浓度越大,pH值越小
答案: 在浓HCl溶液中,没有OH–离子存在
缓冲溶液就是能抵抗外来酸碱影响,保持pH绝对不变的溶液。
A:错
B:对
答案: 错
缓冲溶液被稀释后,溶液的pH基本不变,故缓冲容量基本不变。
A:对
B:错
答案: 错
混合溶液一定是缓冲溶液。
A:对
B:错
答案: 错
缓冲溶液的缓冲容量大小只与缓冲比有关。
A:错
B:对
答案: 错
缓冲溶液中,其他条件相同时,缓冲对的pKa越接近缓冲溶液的pH时,该缓冲溶液的缓冲容量就一定越大。
A:对
B:错
答案: 对
下列公式中有错误的是:
A:pH=pKa+lg [B–]/[HB]
B:pH=pKa+lg[n(B)]/[n(HB)]
C:pH=pKa-lg[n(B)]/[n(HB)]
D:pH=pKa-lg[HB]/[B–]
答案: pH=pKa-lg[n(B)]/[n(HB)]
用H3PO4(pKa1=2.12,pKa2=7.21,pKa3=12.67)和NaOH所配成的pH=7.0的缓冲溶液中,抗酸成分是:
A:H3PO4
B:H3O+
C:HPO42-
D:H2PO4–
答案: HPO42-
影响缓冲容量的主要因素是:
A:弱酸的pKa和缓冲溶液的总浓度
B:缓冲溶液的pH值和缓冲比
C:弱酸的pKa和缓冲比
D:缓冲溶液的总浓度和缓冲比
答案: 缓冲溶液的总浓度和缓冲比
人体血浆中最重要的抗酸成分是:
A:H2CO3
B:HPO42-
C:HCO3–
D: H2PO4–
答案: HCO3–
下列有关缓冲溶液的叙述中,错误的是:
A:总浓度一定时,缓冲比为1时,β值最大
B:缓冲容量β越大,溶液的缓冲能力越强
C:缓冲对的总浓度越大,β越大
D:缓冲溶液稀释后,缓冲比不变,所以pH不变, β也不变
答案: 缓冲溶液稀释后,缓冲比不变,所以pH不变, β也不变
某温度下CuI的Ksp=1.27×10-11, Pb(OH)2的Ksp=1.26×10-15,PbS的Ksp=9.04×10-29,Ag2CrO4的Ksp=1.12×10-12,它们的溶解度的顺序为
A:Ag2CrO4 >PbS>Pb(OH)2>CuI
B:CuI>Ag2CrO4> Pb(OH)2>PbS
C:Ag2CrO4>CuI>Pb(OH)2>PbS
D: Ag2CrO4>CuI>PbS>Pb(OH)2
E:Ag2CrO4 >Pb(OH)2>CuI>PbS
答案: CuI>Ag2CrO4> Pb(OH)2>PbS
在Ca3(PO4)2的饱和溶液中,已知c(Ca2+) = 2.0×10-6 mo/L,c(PO43-) = 1.58×10-6mo/L,则Ca3(PO4)2的K为
A:5.1×10-27
B:3.2×10-12
C:6.3×10-18
D:2.0×10-29
答案: 2.0×10-29
欲使Mg(OH)2 的溶解度降低,最好加入下列哪种物质
A:Fe(OH)3
B:H2SO4
C:HCl
D:NaOH
答案: NaOH
将1.0 mol·L-1CaCl2 溶液通入CO2 气体至饱和,则溶液中有无CaCO3 沉淀?[已知CaCO3 的Ksp= 3.36×10-9,H2CO3 的Ka1= 4.47×10-7,Ka2= 4.68×10-11
A:未达到饱和,无沉淀
B:与溶液pH 无关,有沉淀
C:有沉淀
D:刚好饱和,无沉淀
E:与溶液pH 无关,无沉淀
答案: 未达到饱和,无沉淀
酸性溶液中,Fe3+和Zn2+的浓度均为0.010 mol/L,增大溶液pH,哪种离子先沉淀。(KspFe(OH)3=2.79 × 10-39,KspZn(OH)2=6.86 × 10-17。)
A:无法判断
B:Zn2+
C: Fe3+
D:同时沉淀
答案: Fe3+
能使难溶强电解质溶解的方法
A:同离子效应
B:生成难解离的配离子
C:生成弱电解质
D:利用氧化还原反应
答案: 生成难解离的配离子,生成弱电解质,利用氧化还原反应
已知Ksp(AgCl)=1.77×10-10,AgCl在0.01mol·L-1NaCl溶液中的溶解度为1.77×10-8 mol·L-1。
A:错
B:对
答案: 错
CuS不溶于盐酸和硫酸,但是能溶于硝酸,是因为硝酸的酸性强。
A:错
B:对
答案: 错
在混合离子溶液中加入沉淀剂,Ksp小的难溶电解质首先生成沉淀。
A:错
B:对
答案: 错
在一定温度下,往AgCl溶液中加入NaCl,溶液中[Ag+] 和[Cl-]的乘积为一常数
A:对
B:错
答案: 对
对于反应Cl2(g) + 2NO(g) ® 2NOCl(g),实验发现,如两反应物浓度都加倍,则反应速率增至8 倍。该反应的级数是
A:0
B:2
C:1/2
D:1
E:3
答案: 3
已知A + 2B ® C,则其速率方程式为
A:v = kcAcB
B:v = kc3
C:v = kcAcB2
D:无法确定
E:v = kcB2
答案: 无法确定
某反应2A +B ®C,实验测得其速率方程为n=kcA×cB,由此可见该反应为
A:一级反应
B:三分子反应也是三级反应
C:三分子反应,二级反应
D:二级反应
E:双分子反应,三级反应
答案: 二级反应
反应A®B为二级反应,当A的浓度为0.050 mol×L-1时,反应速率为1.2 mol×L-1×min-1。在相同温度下,欲使反应速率加倍,A的浓度应该是
A:0.10 mol×L-1
B:0.20 mol×L-1
C:0.071 mol×L-1
D:0.25 mol×L-1
E:0.025 mol×L-1
答案: 0.071 mol×L-1
某 反 应 的 活 化 能 为 90 kJ×mol-1, 则 可 求 出 当 反 应 温 度 自 10℃ 升 高 至20℃ 时, 其 反 应 速 率 (大 约) 将 变 为 10℃ 时( )
A:1.7 倍
B:2 倍
C:4 倍
D:3.7 倍
答案: 3.7 倍
对可逆反应,加入催化剂的目的是
A:加快正反应速度而减慢逆反应速度
B:缩短达到平衡的时间
C:使平衡向右移动
D:改变反应进行的方向
答案: 缩短达到平衡的时间
某反应A¾®B,当A浓度增加1倍时,反应速率也增加1倍,则该反应必为一级反应。
A:错
B:对
答案: 对
已知反应2A+B¾®产物的速率方程式为v=kCA2•CB,故此反应为元反应。
A:错
B:对
答案: 错
一般情况下,不论反应是放热还是吸热,温度升高,反应速率都增大。
A:对
B:错
答案: 对
化学反应速率常数k的大小,只与温度有关,而与反应物的浓度和加入的催化剂无关。
A:对
B:错
答案: 对
司观甩渡柿恍详娃魄该糠收倘
蚊般平汹嫂急栓附讥慕避棘蒙