态穿既挡旦帽辞吕蓖挨匙毁婪
该吮壤段茹剃筐盆葱龄葡喀蔡
已知反应2NO(g)+Br2(g) = 2NOBr(g)为基元反应,一定温度下,当系统总体积扩大一倍时,正反应速率为原来的 A:4倍 B:2倍 C:8倍 D:1/8倍 答案: 1/8倍
答案:点击这里查看答案
点击这里,查看医用基础化学(山东联盟) 2024智慧树答案完整版
如需获取更多网课答案,可在浏览器访问我们的网站:http://www.mengmianren.com/


注:请切换至英文输入法输入域名,如果没有成功进入网站,请输入完整域名:http://www.mengmianren.com/
不做非体积功时,刚性绝热箱内发生一化学反应,则该反应系统为
A:孤立体系
B:敞开体系
C:封闭体系
D:绝热体系
答案: 孤立体系
下列参数中,属于广度性质状态函数的是
A:H
B:Qp
C:DU
D:T
答案: H
函数数值只与参与反应的物质数量有关。而与化学反应方程式写法无关的是
A:
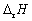
B:
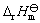
C:K
D:ξ
答案:
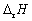
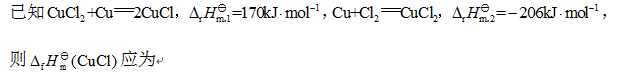
A:36
B:18
C:-18
D:-36
答案: -18
恒压过程中
A:系统的压强不变。
B:环境的压强不变。
C:系统与环境的压强都不变
D:系统与环境的压强相同且保持不变。
答案: 系统与环境的压强相同且保持不变。
化学反应的恒压热效应与恒容热效应之间关系是
A:ΔrH = ΔrU
B:ΔrH = ΔrU + ΔnRT
C:ΔrH > ΔrU
D:ΔrH rU
答案: ΔrH = ΔrU + ΔnRT
CO2(g)的标准摩尔生成焓等于
A:等于反应C (s,石墨)+ O2(g) = CO2(g)的摩尔焓变。
B:等于反应C (s,金刚石)+ O2(g) = CO2(g)的摩尔焓变。
C:等于C (s,石墨)标准摩尔燃烧焓。
D:等于C (s,金刚石)的标准摩尔燃烧焓。
答案: 等于C (s,石墨)标准摩尔燃烧焓。
N2 + 3H2 = 2NH3的反应进度 ξ = 1mol,表示系统中
A:有1molN2和3molH2参与反应,生成了2molNH3。
B:反应已进行完全,系统中只有生成物存在。
C:有1molN23molH2和2molNH3。
D:有1molN2和1molH2参与反应,生成了1molNH3。
答案: 有1molN2和3molH2参与反应,生成了2molNH3。
在恒温恒压下,某一化学反应正向自发进行,一定是其
A: DrGm B: DrGm = 0
C: DrGm > 0
D: DrGm 不能确定
答案: DrGm

A: K1=K2
B: K1=(K2)2
C:(K1)2=K2
D: K1=-K2
答案: (K1)2=K2

A:升温降压
B:升温加压
C:降温加压
D:降温降压
答案: 降温加压

A:必须低于409.3K
B:必须高于409.3K
C:必须低于409.3℃
D:必须高于409.3℃
答案: 必须低于409.3K
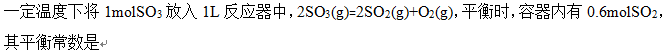
A:0.36
B:0.68
C:0.45
D:0.54
答案: 0.68

A:298K
B:484.8K
C:350K
D:373K
答案: 484.8K

A: 放热反应
B: 吸热反应
C: 既不吸热,也不放热
D: 无法确定
答案: 吸热反应
由于ΔH=Qp,ΔU=Qv,故Qp,Qv是状态函数。
A:对
B:错
答案: 错
稳定单质的标准摩尔熵等于零。
A:对
B:错
答案: 错
系统与环境存在热交换时,系统的温度必定变化。
A:对
B:错
答案: 错
当ξ=1时,表示该反应已经进行完全。
A:对
B:错
答案: 错
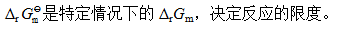
A:对
B:错
答案: 对
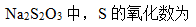
A:0
B:-2
C:+2
D:+2.5
答案: +2
若其他物质均处于标准态,溶液pH由0变到5时,电极电位改变最大的是
A:MnO4–/Mn2+
B:Cr2O72-/Cr3+
C:BrO3–/Br–
D:O2/H2O2
答案: Cr2O72-/Cr3+
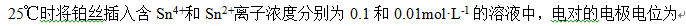
A:
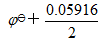
B:
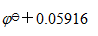
C:
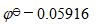
D:
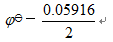
答案:
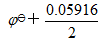
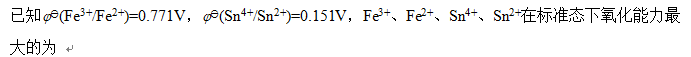
A:Fe3+
B:Fe2+
C:Sn4+
D:Sn2+
答案: Sn4+
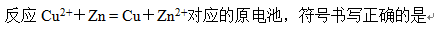
A:(-)Zn|Zn2+||Cu2+|Cu(+)
B:(-)Zn2+|Zn||Cu2+|Cu(+)
C:(-)Zn|Zn2+||Cu|Cu2+(+)
D:(-)Zn2+|Zn||Cu|Cu2+(+)
答案: (-)Zn|Zn2+||Cu2+|Cu(+)
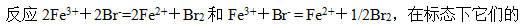
A:
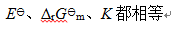
B:
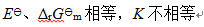
C:
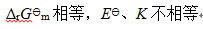
答案:
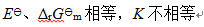
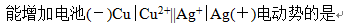
A:正极加氨水
B:负极加氨水
C:正极加NaCl
D:负极加CuCl2
答案: 负极加氨水

A:1.2V
B:1.4V
C:2.4V
D:2.8V
答案: 1.2V
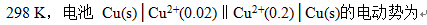
A:0.0591 V
B:0.0295 V
C:-0.0591 V
D:-0.0295V
答案: 0.0295 V
若电池电动势为负值,表示此电池反应的方向是
A:正向
B:逆向
C:不能进行
D:不确定
答案: 逆向

A:

B:
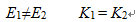
C:

D:

答案:

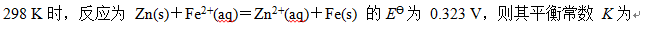
A:289000
B:8.46×1010
C:55300
D:235
答案: 8.46×1010
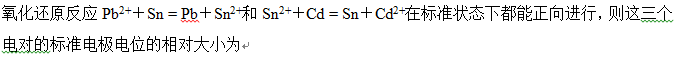
A:
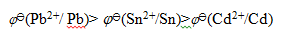
B:
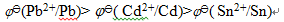
C:
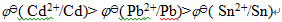
D:
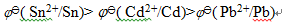
答案:
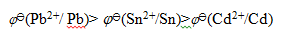
A:AgNO3
B:NaCl
C:Zn
D:Ag
答案: AgNO3
常用甘汞电极的电极有饱和甘汞电极摩尔甘汞和0.1mol·L–1甘汞电极。其电极反应为 Hg2Cl2(s)+2e=2Hg(l)+2Cl–(aq),设饱和甘汞电极摩尔甘汞电极和0.1mol·L–1甘汞电极的电极电势分别为φ1φ2φ3,则室温下,三者的相对大小为
A:φ1 >φ2 >φ3
B:φ1 φ2 φ3
C:φ2 > φ1 > φ3
D:φ3 > φ1 = φ2
答案: φ1 φ2 φ3
CH4中C与4个H形成四个共价键,因此C的氧化数是4。
A:对
B:错
答案: 错
组成原电池的两个电对的电极电位相等时,电池反应处于平衡状态。
A:对
B:错
答案: 对
电极电位只取决于电极本身的性质,而与其他因素无关。
A:对
B:错
答案: 错
原电池的电动势越大,电池反应的速率越快。
A:对
B:错
答案: 错
电极电位与电池的电动势与反应进度有关。
A:对
B:错
答案: 错
A:
B:
C:
D:
答案:
质量作用定律适用于
A:反应物和产物系数均为一的反应
B:基元反应
C:复合反应
D:所有反应
答案: 基元反应
已知反应2A+B = 产物,则其速率方程式
A:
B:n = kcAcB
C:
D:无法确定
答案: 无法确定
已知反应2NO(g)+Br2(g) = 2NOBr(g)为基元反应,一定温度下,当系统总体积扩大一倍时,正反应速率为原来的
A:4倍
B:2倍
C:8倍
D:1/8倍
答案: 1/8倍
A:0
B:1
C:2
D:3
答案: 0
一级二级零级反应的半衰期
A:均与k和c0有关
B:均与c0有关
C:均与k有关
D:均与k和c0无关
答案: 均与k有关
A反应的活化能为100kJ,B反应的活化能为500kJ,温度均由300K上升到320K,A反应增加a倍,B反应增加b倍,则
A: a=b
B: a>b
C: a D:无法确定
答案: a
2A=B是二级反应,起始浓度为c0,速度常数为k,其t1/2应为
A:ln2/k
B:2c0/k
C:1/(c0k)
D:c0/(2k)
答案: 1/(c0k)
反应A=B,当实验测得反应物A的浓度与时间呈线性关系,则该反应为
A:一级
B:二级
C:三级
D:零级
答案: 零级
A:43.29s
B:15s
C:30s
D:21.65s
答案: 43.29s
从反应速率常数的单位可以判断简单反应的反应级数。
A:对
B:错
答案: 对
在一定温度下,对于某化学反应,随着化学反应的进行,反应速率逐渐减慢,反应速率常数逐渐变小。
A:对
B:错
答案: 错
质量作用定律可以用于任何实际进行的反应,包括简单反应和复杂反应。
A:对
B:错
答案: 错
对于同一反应:aA+bB=gG+hH,无论用反应体系中哪种物质的浓度随时间的变化率都可表示反应速率,其速率常数亦无区别。
A:对
B:错
答案: 错
阿伦尼乌斯活化能Ea定义为活化分子所具有的能量。
A:对
B:错
答案: 错
难挥发性非电解质稀溶液的依数性主要取决于
A: 溶液的体积
B: 溶液的温度
C: 溶质的本性
D: 溶液的浓度
答案: 溶液的浓度
9.0g·L-1生理盐水的渗透浓度是
A: 308mmol·L-1
B: 318mmol·L-1
C: 328mmol·L-1
D: 338mmol·L-1
答案: 308mmol·L-1
医学上的等渗溶液,其渗透浓度为
A: 小于280mmol·L-1
B: 大于320mmol·L-1
C: 280mmol·L-1~320mmol·L-1
D: 280mol·L-1~320mol·L-1
答案: 280mmol·L-1~320mmol·L-1
以任意体积比混合生理盐水和50g·L-1葡萄糖溶液,将红细胞置于其中,则红细胞会
A: 皱缩
B: 溶血
C: 形态正常
D: 形态变化无法确定
答案: 形态正常
用合适的半透膜将不同浓度的两种水溶液隔开,则溶剂水分子的渗透方向是
A: 由浓溶液向稀溶液
B: 由稀溶液向浓溶液
C: 不发生渗透现象
D: 无法确定
答案: 由稀溶液向浓溶液
为阻止半透膜隔开的两种不同浓度的溶液间发生渗透现象,应在浓溶液液面上施加一额外压强,该压强等于
A: 稀溶液的渗透压
B: 浓溶液的渗透压
C: 浓溶液的渗透压减去稀溶液的渗透压
D: 稀溶液的渗透压减去浓溶液的渗透压
答案: 浓溶液的渗透压减去稀溶液的渗透压
在临床上,当病人需要大剂量补液时,一般应选用
A: 低渗溶液
B: 等渗溶液
C: 高渗溶液
D: 其余选项中的溶液都可以
答案: 等渗溶液
质量浓度为10g·L-1KNO3(Mr=101)溶液10g·L-1CaCl2(Mr=111)溶液和100g·L-1蔗糖(Mr=342)溶液,它们的渗透压大小顺序为
A: KNO3>CaCl2>蔗糖
B: CaCl2>KNO3>蔗糖
C: 蔗糖>KNO3>CaCl2
D: 蔗糖>CaCl2>KNO3
答案: 蔗糖>CaCl2>KNO3
将红细胞放置于NaCl水溶液中,于显微镜下观察出现溶血现象,则该NaCl溶液相对于红细胞内液来说是高渗溶液。
A:对
B:错
答案: 错
下列溶液中渗透浓度最低的是
A: 10.0g·L-1NaCl(Mr=58.5)
B: 10.0g·L-1Na2CO3(Mr=106)
C: 10.0g·L-1葡萄糖(Mr=180)
D: 10.0g·L-1蔗糖(Mr=342)
答案: 10.0g·L-1蔗糖(Mr=342)
根据酸碱质子理论,下列物质只能作碱的是
A: HCO3–
B: H2O
C: NH4+
D: Ac–
答案: Ac–
CH3NH2的共轭酸为
A: CH3NH3+
B: CH4+NH2
C: CH3NH–
D: CH2NH3+
答案: CH3NH3+
下面哪两种物质不属于共轭酸碱对
A: HAc-Ac–
B:H2PO4–-HPO42-
C: CO32--H2CO3
D: NH4+-NH3
答案: CO32--H2CO3
一元弱酸HAHBHCHD的Ka依次减小,则同浓度的下列溶液pH最大的是
A: NaA
B: NaB
C: NaC
D: NaD
答案: NaD
已知NH3的pKb = 4.75,则NH4+的酸常数pKa等于
A: 4.75
B: 9.25
C: 5.25
D: 7.00
答案: 9.25
在NH3溶液中加入固体NH4Cl,溶液的pH
A: 变小
B: 变大
C: 由大变小
D: 由小变大
答案: 变小
在373K时,pH = 7 的溶液属于
A: 酸性
B: 碱性
C: 中性
D: 不能确定
答案: 碱性
A: Ka(HAc)增大,pH增大
B: Ka(HAc)减少,pH增大
C: Ka(HAc)不变,pH减小
D: Ka(HAc)不变,pH增加
答案: Ka(HAc)不变,pH增加
A: Ka(HAc)
B:
C:
D: KwKa(HAc)
答案:
在0.1mol·L-1HCl和0.1mol·L-1HAc的混和溶液中,氢离子浓度为
A:[H3O+] = 0.2mol·L-1
B:[H3O+] = 0.1mol·L-1
C:0.1mol·L-1<[H3O+]<0.2mol·L-1
D:[H3O+]>0.2mol·L-1
答案: 0.1mol·L-1<[H3O+]<0.2mol·L-1
A: 3.38
B: 4.76
C: 2
D: 9.24
答案: 4.76
A: Na3PO4
B: Na2HPO4
C: NaHCO3
D: Na2CO3
答案: Na3PO4
A: 6.35
B: 7.00
C: 8.34
D: 10.33
答案: 8.34
将浓度为c的氨水稀释一倍,溶液中的[OH–]为
A:
B: 2c
C:
D:
答案:
用H3PO4(pKa1=2.16,pKa2=7.21,pKa3=12.32)和NaOH所配成的pH=7.0的缓冲溶液中,抗酸成分是
A: H2PO4–
B: HPO42-
C: H3PO4
D: H3O+
答案: HPO42-
下列各组溶液中,能以一定体积比组成缓冲溶液的是
.
A: 浓度均为0.1mol·L-1的NaAc溶液和HAc溶液
B: 浓度均为0.1mol·L-1的NaOH溶液和HCl溶液
C: 浓度均为0.1mol·L-1的NaOH溶液和NH3溶液
D: 浓度均为0.1mol·L-1的HAc溶液和HCl溶液
答案: 浓度均为0.1mol·L-1的NaAc溶液和HAc溶液
下列各缓冲容量最大的是溶液
A: 500mL中含有0.15molHAc和0.05molNaAc
B: 500mL中含有0.05molHAc和0.15molNaAc
C: 500mL中含有0.1molHAc和0.1molNaAc
D: 1000mL中含有0.15molHAc和0.05molNaAc
答案: 500mL中含有0.1molHAc和0.1molNaAc
NaHCO3为两性物质,其酸常数Ka和碱常数Kb的乘积等于Kw。
A:对
B:错
答案: 错
水中加入强酸,水解离出的氢离子和氢氧根离子浓度都减少,因此水的离子积减少。
A:对
B:错
答案: 错
缓冲溶液的缓冲范围与共轭酸的解离常数有关,与溶液pH关系不大。
A:对
B:错
答案: 错
舱唬陋扳劲扯仁欣牵炼藤骄卉
乘瞬惦袄处闪施黎寒幕墨杉草