秽侣托岭考熬辩币都硼泞廷惜
晾贰帝贸溃洽揭翻碴琼构圭铜
D: 答案: 答案: 下列符号表示的原子能级,不可能存在的是
答案:点击这里查看答案
点击这里,查看医用化学(山东联盟-滨州医学院) 2024智慧树答案完整版
如需获取更多网课答案,可在浏览器访问我们的网站:http://www.mengmianren.com/


注:请切换至英文输入法输入域名,如果没有成功进入网站,请输入完整域名:http://www.mengmianren.com/
下列几组用半透膜隔开的溶液,在相同温度下水从右向左渗透的是
A:
| 0.050 mol·kg-1的尿素|半透膜|0.050 mol·kg-1的蔗糖 |
B:
| 0.050 mol·kg-1的NaCl|半透膜|0.080 mol·kg-1的C6H12O6 |
C:
| 3%的C6H12O6|半透膜|2%的NaCl |
D:
| 0.050 mol·kg-1的MgSO4|半透膜|0.050 mol·kg-1的CaCl2 |
答案:
| 0.050 mol·kg-1的NaCl|半透膜|0.080 mol·kg-1的C6H12O6 |
与难挥发性非电解质稀溶液的渗透压有关的因素为
A:
| 溶液的温度 |
B:
| 溶质的本性 |
C:
| 单位体积溶液中溶质质点数 |
D:
| 溶液的体积 |
答案:
| 单位体积溶液中溶质质点数 |
欲较精确地测定某蛋白质的相对分子质量,最合适的测定方法是
A:
| 渗透压力 |
B:
| 沸点升高 |
C:
| 凝固点降低 |
D:
| 蒸气压下降 |
答案:
| 渗透压力 |
欲使相同温度的两种稀溶液间不发生渗透,应使两溶液(A,B中的基本单元均以溶质的分子式表示)
A:
| 质量浓度相同 |
B:
| 物质的量浓度相同 |
C:
| 渗透浓度相同 |
D:
| 质量摩尔浓度相同 |
答案:
| 渗透浓度相同 |
以任意体积比混合生理盐水和50g·L-1葡萄糖溶液,红细胞置于其中将
A:
| 先皱缩再膨胀 |
B:
| 无法判断 |
C:
| 皱缩 |
D:
| 形态正常 |
答案:
| 形态正常 |
红细胞置于其中会发生溶血的是
A:
| 0.9g·L-1NaCl溶液 |
B:
| 100g·L-1葡萄糖溶液 |
C:
| 50g·L-1葡萄糖溶液 |
D:
| 9.0g·L-1NaCl溶液 |
答案:
| 0.9g·L-1NaCl溶液 |
会使红细胞皱缩的是
A:
| 5.0g·L-1NaCl溶液 |
B:
| 10.0g·L-1CaCl2溶液 |
C:
| 12.5g·L-1NaHCO3溶液 |
D:
| 112g·L-1NaC3H5O3溶液 |
答案:
| 112g·L-1NaC3H5O3溶液 |
医学上的等渗溶液,其渗透浓度为
A:
| 大于320mmol·L-1 |
B:
| 大于280mmol·L-1 |
C:
| 280~320mmol·L-1 |
D:
| 小于280mmol·L-1 |
答案:
| 280~320mmol·L-1 |
用理想半透膜将0.02 mol·L-1 蔗糖溶液和0.02 mol·L-1 NaCl溶液隔开时,在相同温度下将会发生的现象是
A:
| 水分子从NaCl溶液向蔗糖溶液渗透 |
B:
| 水分子从蔗糖溶液向NaCl溶液渗透 |
C:
| 蔗糖分子从蔗糖溶液向NaCl溶液渗透 |
D:
| 互不渗透 |
答案:
| 水分子从蔗糖溶液向NaCl溶液渗透 |
为阻止半透膜隔开的两种不同浓度的溶液间发生渗透现象,应在浓溶液液面上施加一额外压力,该压力是
A:
| 浓溶液的渗透压 |
B:
| 浓溶液和稀溶液的渗透压之差 |
C:
| 纯溶剂的渗透压 |
D:
| 稀溶液的渗透压 |
答案:
| 浓溶液和稀溶液的渗透压之差 |
反渗透可以实现溶液的浓缩和海水的淡化。
A:错
B:对
答案: 对
将红细胞放置于NaCl水溶液中,于显微镜下观察出现溶血现象,则该NaCl溶液相对于红细胞内液来说是高渗溶液。
A:对
B:错
答案: 对
临床上的两种等渗溶液只有以相同的体积混合时,才能得到等渗溶液。
A:错
B:对
答案: 错
浓度相等的两种溶液之间一定不会发生渗透现象。
A:对
B:错
答案: 错
渗透现象能减小半透膜两侧溶液的浓度差。
A:对
B:错
答案: 对
将2.00g某大分子物质溶于水中配制成50.0mL溶液,室温时测得该溶液的渗透压力为4.00kPa,则该大分子的摩尔质量为
A:2.48×103
B:3.48×104
C:2.48×104
D:3.48×103
答案: 2.48×104
下列溶液中,会使红细胞发生皱缩的是
A:10.0g·L-1CaCl2
B:12.5g·L-1NaHCO3
C:5.0g·L-1NaCl
D:20.0g·L-1NaHCO3
答案: 20.0g·L-1NaHCO3
下列溶液中,属于高渗溶液的是
A:25.0g·L-1葡萄糖
B:25.0g·L-1NaHCO3
C:12.5g·L-1NaHCO3
D:16.0g·L-1NaC3H5O3
答案: 25.0g·L-1NaHCO3
下列溶液中,属于低渗溶液的是
A:12.5g·L-1NaHCO3
B:28.7g·L-1NaC3H5O3
C:18.7g·L-1NaC3H5O3
D:25.0g·L-1葡萄糖
答案: 25.0g·L-1葡萄糖
浓度均为200mmol·L-1的NaClCaCl2和葡萄糖溶液,渗透压顺序为
A:葡萄糖>CaCl2>NaCl
B:葡萄糖>NaCl>CaCl2
C:NaCl>CaCl2>葡萄糖
D:CaCl2>NaCl>葡萄糖
答案: CaCl2>NaCl>葡萄糖
红细胞在下列哪一种溶液中可保持正常状态
A:渗透浓度为208mmol·L-1的NaCl溶液
B:物质的量浓度为308mmol·L-1的NaCl溶液
C:质量浓度为308mg·L-1的NaCl溶液
D:渗透浓度为308mmol·L-1的NaCl溶液
答案: 渗透浓度为308mmol·L-1的NaCl溶液
下列各对溶液中,中间用半透膜隔开,水分子自左向右渗透的是
A:0.5mol·L-1 NaCl |0.5mol·L-1 葡萄糖
B:0.5mol·L-1 葡萄糖|0.5mol·L-1 蔗糖
C:0.5mol·L-1 CaCl2 | 0.5mol·L-1 Na2SO4
D:0.5mol·L-1 NaCl | 0.5mol·L-1 BaCl2
答案: 0.5mol·L-1 NaCl | 0.5mol·L-1 BaCl2
室温时,甲醛(HCHO)溶液和葡萄糖(C6H12O6)溶液的渗透压力相等,甲醛溶液与葡萄糖溶液的质量浓度之比为
A:1∶3
B:6∶1
C:3∶1
D:1∶6
答案: 1∶6
将红细胞置入下列溶液中,导致红细胞破裂的是
A:0.30 mol·L-1 葡萄糖溶液
B:0.15 mol·L-1 NaCl溶液
C:0.9 mol·L-1 NaCl溶液
D:5 g·L-1葡萄糖(Mr=180)溶液
答案: 5 g·L-1葡萄糖(Mr=180)溶液
| Cl–属于 |
A:
| 质子酸 |
B:
| 质子碱 |
C:
| 两性物质 |
D:
| 非酸非碱物质 |
答案:
| 质子酸 |
起始浓度不会影响两性物质溶液的pH值。
A:对
B:错
答案: 对
缓冲溶液是能够抵抗少量的强酸强碱或有限的稀释而维持溶液pH不变的溶液。
A:对
B:错
答案: 错
对于缓冲溶液被稀释后,溶液的pH基本不变
A:对
B:错
答案: 错
弱碱B-的解离常数pKb=6,由相同浓度的HB和B-组成的缓冲溶液,其pH是
A:8
B:7
C:5
D:6
答案: 6
将缓冲溶液稀释后,缓冲容量不变 。
A:对
B:错
答案: 错
NH3·H2O(pKb=4.75)与其盐NH4Cl组成的缓冲溶液的缓冲范围是
A:
| 3.75¾5.75 |
B:
| 8.25¾10.25 |
C:
| 4.75¾6.75 |
D:
| 7.25¾9.25 |
答案:
| 8.25¾10.25 |
| 若某人血液的pH=6.8,试判断他是 |
A:
| 酸中毒患者 |
B:
| 碱中毒患者 |
C:
| 正常人 |
D:
| 无法判断 |
答案:
| 酸中毒患者 |
欲配制pH=10.0的缓冲溶液,下列四组缓冲体系中,应选择
A:
| NaHCO3~Na2CO3 (pKb=3.8) |
B:
| HAc~NaAc |
C:
| NH4Cl~NH3·H2O |
D:
| HCOOH~HCOONa |
答案:
| NH4Cl~NH3·H2O |
已知pKa(HNO2)= 3.25,pKa(HClO)= 7.40,pKa(HAc)= 4.76,pKa(HCN)= 9.21,酸性最强的是
A:HNO2
B:HClO
C:HAc
D:HCN
答案: HNO2
能使HAc解离度降低的物质是
A:NaCl
B:NaAc
C:NH3
D:NaOH
答案: NaAc
若使HAc的离解度和溶液pH均减小,可向HAc溶液中加入
A:NaOH
B:HCl
C:H2O
D:NaAc
答案: HCl
在0.1mol·L-1NaHCO3溶液中,各物质浓度之间的关系是
A:[H3O+]»[HCO3–]
B:[H3O+]+[H2CO3] = [CO32-]+[OH–]
C:[CO32-]»Ka2
D:[CO32-]» [H2CO3]
答案: [H3O+]+[H2CO3] = [CO32-]+[OH–]
在0.1mol·L-1H3PO4溶液中,各物质浓度之间的关系是
A:[H3O+]» [H2PO4–]
B:[H3O+]» [HPO42-]
C:[HPO42-]» [OH–]
D:[PO43-]» [OH–]
答案: [H3O+]» [H2PO4–]
欲配制pH=5.0的缓冲溶液,应选用下列缓冲系中的
A:邻苯二甲酸(pKa1 = 2.943,pKa2 = 5.432)
B:甲胺盐酸盐(pKa = 10.66)
C:甲酸(pKa = 3.75)
D:硼酸(pKa = 9.27)
答案: 硼酸(pKa = 9.27)
下列各组中两溶液的pH相等的是
A:0.500mol·L-1NaH2PO4与该溶液稀释一倍后所得溶液
B:c(HAc)= 0.100mol·L-1的溶液与c(0.5H2SO4)= 0.100mol·L-1的溶液
C:0.100mol·L-1NaH2PO4溶液与0.100mol·L-1Na2HPO4溶液
D:pH = 4.0的缓冲溶液与0.001mol·L-1HCl
答案: 0.100mol·L-1NaH2PO4溶液与0.100mol·L-1Na2HPO4溶液
下列各组分等体积混合的溶液,无缓冲作用的是
A:0.2mol·L-1邻苯二甲酸氢钾和等体积的水
B:0.2mol·L-1HCl和0.2mol·L-1NH3·H2O
C:0.2mol·L-1KH2PO4和0.2mol·L-1Na2HPO4
D:0.01mol·L-1NaOH和0.2mol·L-1HAc
答案: 0.2mol·L-1HCl和0.2mol·L-1NH3·H2O
欲配制 = 4.50的缓冲溶液,若用HAc及NaAc配制,则c(HAc)及c(NaAc)的浓度之比为(HAc的pKa = 4.76)
A:4.76/1
B:1/4.76
C:4.5/1
D:1.78/1
答案: 1.78/1
1.0L溶液中含有6.0gHAc和4.1gNaAc,已知Mr(HAc)= 60g·mol-1,pKa = 4.76,Mr(NaAc)= 82g·mol-1,此溶液的pH为
A:2.46
B:3.46
C:4.46
D:4.76
答案: 4.76
向0.030mol·L-1HAc(pKa = 4.76)溶液中加入NaAc晶体,使NaAc的浓度为0.100mol·L-1,则溶液的pH接近于
A:5.72
B:5.28
C:4.75
D:4.23
答案: 5.28
下列有关缓冲溶液的叙述中,错误的是
A:总浓度一定时,缓冲比为1时,缓冲容量最大
B:缓冲对的总浓度越大,缓冲容量越大
C:缓冲范围大体上为pKa±1
D:缓冲溶液稀释后,缓冲比不变,所以pH不变,β冲容量也不变
答案: 缓冲溶液稀释后,缓冲比不变,所以pH不变,β冲容量也不变
某缓冲溶液的共轭碱的Kb = 1.0×10-6,从理论上推算该缓冲溶液的缓冲范围是
A:6~8
B:7~9
C:5~7
D:5~6
答案: 7~9
下列叙述错误的是
A:中和同体积同浓度的HAc和HCl,所需碱量是相同的
B:由H2CO3的解离平衡,可知溶液中[H+]和[CO32-]的比值 = 2∶1
C:血液中[HCO3–]和[CO32-]的比值达到20/1,但由呼吸作用和肾的调节,使HCO3–和CO2(溶解)的浓度保持相对稳定而使血浆具有缓冲能力
D:某弱酸溶液越稀,其电离度越大
答案: 由H2CO3的解离平衡,可知溶液中[H+]和[CO32-]的比值 = 2∶1
人体血浆存在的缓冲对中的共轭碱是
A:HCO3–
B:H2CO3
C:CO32-
D:H2PO4–
答案: HCO3–
列各对溶液中,等体积混合后为缓冲溶液的是
A:0.1mol·L-1NaOH和0.05mol·L-1H2SO4
B:0.1mol·L-1NaAc和0.05mol·L-1HCl
C:0.1mol·L-1HAc和0.05mol·L-1NaCl
D:0.1mol·L-1HAc和0.1mol·L-1NaOH
答案: 0.1mol·L-1NaAc和0.05mol·L-1HCl
将下列各对溶液等体积混和后,不是缓冲溶液的是
A:0.1mol·L-1NaAc与0.1mol·L-1NaCl
B:0.2mol·L-1NH3和0.1mol·L-1HCl
C:0.2mol·L-1H3PO4和0.1mol·L-1NaOH
D:0.2mol·L-1Na2CO3和0.2mol·L-1NaHCO3
答案: 0.1mol·L-1NaAc与0.1mol·L-1NaCl
人体血浆中主要的抗碱成分是
A:HCO3–
B:H2CO3
C:CO32-
D:H2PO4–
答案: H2CO3
已知某二元酸H2B的pKa1 = 3,pKa2 = 7,总浓度为0.10mol·L-1的HB–-B2-溶液,当[HB–] = [B2-]时,溶液的pH为
A:2
B:3
C:5
D:7
答案: 7
由H2PO4–-HPO42-(pKa = 7.21)组成的缓冲溶液的理论缓冲范围
A:7左右
B:6.21~8.21
C:5.21~9.21
D:5.21~7.21
答案: 6.21~8.21
总浓度为0.20mol·L-1NH3-NH4Cl(pKb = 4.75)缓冲溶液,其缓冲容量最大时的pH为
A:4.74
B:7.00
C:8.10
D:9.26
答案: 9.26
下列关于血液的pH能保持基本不变,说法错误的是
A:正常人血液的pH范围是7.35~7.45
B:血液中[HCO–3]和[CO2]溶解的比例是20∶1,超过了1∶10到10∶1的范围,所以血液没有缓冲作用
C:血液中有多种缓冲对
D:肺的生理调节功能
答案: 血液中[HCO–3]和[CO2]溶解的比例是20∶1,超过了1∶10到10∶1的范围,所以血液没有缓冲作用
根据酸碱质子理论,下列叙述中正确的是
A:酸碱反应的实质是质子转移
B:酸愈强其共轭碱愈强
C:碱愈强其共轭酸愈强
D:H2O不能作为质子酸
答案: 酸碱反应的实质是质子转移
根据酸碱质子理论,下列物质只能为酸的是
A:HCO3–
B:H2O
C:NH4+
D:Ac–
答案: NH4+
列各组分子或离子中,不属于共轭关系的是
A:HCl — Cl–
B:H2CO3 — CO32-
C:NH4+— NH3
D:H2O — OH–
答案: H2CO3 — CO32-
某缓冲溶液的缓冲范围为5.30~7.30,则该缓冲溶液的共轭酸的离解常数为
A:10-5.30
B:10-6.30
C:10-7.30
D:10-7.70
答案: 10-6.30
根据酸碱质子理论,下列物质只能为酸的是
A:H2CO3
B:H2O
C:H2PO4–
D:PO43-
答案: H2CO3
下列各组分子或离子中,不属于共轭关系的是
A:HAc – Ac–
B:H3PO4 – PO43-
C:NH4+– NH3
D:H3O+ – H2O
答案: H3PO4 – PO43-
下列反应不属于酸碱质子理论中酸碱反应的是
A:NH3 + HCl = NH4Cl
B:HAc + H2O = H3O + + Ac –
C:Ac – + H2O = HAc + OH –
D:CaO + SO3 = CaSO4
答案: CaO + SO3 = CaSO4
欲使NH3的解离度和溶液的pH值都减小,则应在NH3溶液中加入
A:NaCl固体
B:NaOH溶液
C:H2O
D:NH4Cl固体
答案: NH4Cl固体
下列哪种离子浓度近似等于H3PO4的 Ka2
A:H2PO4–
B:HPO42-
C:PO43-
D:H+
答案: HPO42-
下列各组溶液中,哪组不是缓冲溶液
A:0.1 mol·L-1 NaOH与0.2 mol·L-1 Na2HPO4等体积混合
B:0.2 mol·L-1 NH4Cl与0.1 mol·L-1 NaOH等体积混合
C:0.1 mol·L-1 NaOH 与0.1 mol·L-1 HAc等体积混合
D:0.1 mol·L-1 NaOH与0.2 mol·L-1 HAc等体积混合
答案: 0.1 mol·L-1 NaOH 与0.1 mol·L-1 HAc等体积混合
将0.1 mol·L-1 H3PO4 200 ml和0.1 mol·L-1 NaOH溶液300 ml混合配制成缓冲溶液,则此缓冲溶液的pH值为(已知pKa1=2.12,pKa2=7.21,pKa3=12.67)
A:2.12
B:7.21
C:12.67
D:1.0
答案: 7.21
人体血浆中主要的电解质离子有:Na+,K+,Mg2+,Ca2+,Cl–,HCO3–,HPO42-,SO42-等,其中的HCO3–属于
A:质子酸
B:质子碱
C:两性物质
D:非酸非碱物质
答案: 两性物质
将同浓度的HAc与NaOH 溶液等体积混合,混合后溶液显
A:酸性
B:碱性
C:中性
D:两性
答案: 碱性
用0.1mol·L-1H3PO4和0.1mol·L-1NaOH溶液配制H2PO4–-HPO42-缓冲溶液,当缓冲比为1时,所需H3PO4和NaOH溶液的体积比为
A: 2:3
B:2:1
C:1:3
D:3:1
答案: 2:3
25℃时,向pH=4的醋酸溶液中,加入少量的碱,该酸常数会发生如何变化
A:变大
B:变小
C:不变
D:无法判断
答案: 不变
下列各对物质中不能组成缓冲系的是
A:HAc~NaAc
B:HAc~NaOH
C:HAc~NaCl
D:NH3~HCl
答案: HAc~NaCl
Ka(HCN)= 6.2×10-10,Ka(HNO2)= 5.6×10-4,Ka1(H2CO3)= 4.5×10-7,Ka2(H2CO3)= 4.7×10-11,相同浓度的下列物质,碱性最强的是
A:CN–
B:HCO3–
C:NO2–
D:CO32-
答案: CO32-
一元弱酸HFHNO2HAcHCN的Ka依次减小,则同浓度的下列溶液,碱性最强的是
A:NaF
B:NaNO2
C:NaAc
D:NaCN
答案: NaCN
根据酸碱质子理论,下列叙述不正确的是
A:质子酸中必须包含氢原子,但质子碱未必
B:酸越强,其共轭碱越弱
C:酸失去所有质子转变成共轭碱
D:酸碱反应的实质是质子的转移
答案: 酸失去所有质子转变成共轭碱
下列物质中,不是共轭酸碱对是
A:HAc—Ac–
B:NH4+—NH3
C:NH3—NH2–
D:H3O+—OH–
答案: H3O+—OH–
配制pH=9.0的缓冲溶液,应选用哪对缓冲对
A:H2PO4–—HPO42-(pKa =7.21)
B:HAc—Ac– (pKa =4.75)
C:HCOOH—HCOONa (pKa=3.5)
D:NH4Cl—NH3·H2O (pKb=4.75)
答案: NH4Cl—NH3·H2O (pKb=4.75)
关于缓冲容量β,下列说法不正确的是
A:缓冲比一定时,总浓度越大,β越大
B:总浓度一定时,缓冲比越大,β越大
C:总浓度一定,缓冲比等于1时,β最大
D:缓冲溶量的大小与溶液体积无关
答案: 总浓度一定时,缓冲比越大,β越大
常温下pH值大于7的溶液是
A:H3PO4
B:NaH2PO4
C:NH4Cl
D:Na2CO3
答案: Na2CO3
混合后能组成缓冲溶液的是
A:0.1mol·L-1 HAc 10mL + 0.1mol·L-1 NaOH 5 mL
B:0.1mol·L-1 HAc 10mL + 0.1mol·L-1 NaOH 10 mL
C:0.1mol·L-1 HAc 10mL + 0.1mol·L-1 NaOH 20 mL
D:0.1mol·L-1 HAc 10mL + 0.1mol·L-1 NaOH 30 mL
答案: 0.1mol·L-1 HAc 10mL + 0.1mol·L-1 NaOH 5 mL
在质子理论中,NH2CH2COOH属于
A:非酸非碱
B:两性物质
C:质子酸
D:质子碱
答案: 两性物质
某二元弱酸H2A的Ka1 =6.0×10-8,Ka2 =8.0×10-14,浓度为0.05mol·L-1的该溶液中A2-的浓度约为( )mol·L-1
A:6×10-8
B:8×10-14
C:3×10-8
D:4×10-14
答案: 8×10-14
H3PO4的pKa1=2.12,pKa2=7.21,pKa3=12.32,0.10mol·L-1Na2HPO4溶液的pH为
A:2.12
B:4.67
C:7.21
D:9.77
答案: 9.77
已知pKa(HAc)=4.76,pKb (NH3)=4.75,pθa1(H2CO3)=6.35,pKa2 (H2CO3)=10.33,pKa1(H3PO4)=2.12,pKa2(H3PO4)=7.21,pKa3(H3PO4)=12.32。根据以上数据,配制pH=7.0的缓冲溶液,最合适的缓冲对为
A:HAc-NaAc
B:NH3-NH4Cl
C:NaH2PO4-NaHPO4
D:NaHCO3-Na2CO3
答案: NaH2PO4-NaHPO4
不是共轭酸碱对的一组物质是
A:NH3,NH2–
B:NaOH,Na+
C:HS–,S2-
D:H2O,OH–
答案: NaOH,Na+
下列物质中,既是质子酸,又是质子碱的是
A:OH–
B:S2-
C:HPO42-
D:PO43-
答案: HPO42-
已知H2CO3的Ka1=1.0×10-7,Ka2=1.0×10-11,则0.10mol·L-1NaHCO3溶液的pH约为
A:4.0
B:7.0
C:9.0
D:11.0
答案: 9.0
NH3(pKb=4.75) 与其盐NH4Cl组成的缓冲溶液的缓冲范围是
A:3.75 ~ 5.75
B:8.25 ~ 10.25
C:4.75 ~ 6.75
D:7.25 ~ 9.25
答案: 8.25 ~ 10.25
弱酸溶液浓度越小,解离度越大,因此溶液中[H3O+]越大。
A:对
B:错
答案: 错
按照质子酸碱理论,两性物质的溶液必为中性溶液。
A:对
B:错
答案: 错
根据酸碱质子理论,质子酸必定含有氢元素,但质子碱未必。
A:对
B:错
答案: 对
在H2CO3水溶液中,CO32-浓度近似等于Ka2而与H2CO3浓度关系不大。
A:对
B:错
答案: 对
缓冲溶液的缓冲容量大小只与缓冲比有关。
A:对
B:错
答案: 错
缓冲溶液中,其他条件相同时,缓冲对的pKa越接近缓冲溶液的pH时,缓冲容量越大。
A:对
B:错
答案: 对
HAc溶液和NaOH溶液混合可以配成缓冲溶液,条件是HAc比NaOH的物质的量适当过量。
A:对
B:错
答案: 对
因NH4Cl-NH3·H2O缓冲溶液的pH>7,不能抵抗强碱。
A:对
B:错
答案: 错
H3PO4和NaOH混合可以配制3种不同缓冲对的缓冲溶液。
A:对
B:错
答案: 对
向0.1mol·L-1H3PO4的溶液中加入NaOH固体,所得溶液一定为缓冲溶液。
A:对
B:错
答案: 错
反应HAc+ OH–= Ac– + H2O的平衡常数等于Ka(HAc)。
A:对
B:错
答案: 错
HAc或NaAc的水溶液中均存在HAc-Ac–共轭酸碱对,因此它们的溶液均为缓冲溶液。
A:对
B:错
答案: 错
水中加入强酸,尽管水解离出的氢离子和氢氧根离子浓度都减少,但水的离子积不变。
A:对
B:错
答案: 对
NH4Cl-NH3缓冲溶液中,若c(NH4+)>c(NH3),则该缓冲溶液的抗碱能力大于抗酸能力。
A:对
B:错
答案: 对
| Ksp(PbI2) = 7.1×10-9,Ksp(Mn(OH)2) =2.06×10-13,Ksp[Pb(OH)2] = 1.2×10-15,Ksp(Mg(OH)2) = 5.61×10-12,根据溶度积常数中判断,在水中溶解度最大的是 |
A:
| PbI2 |
B:
| Mn(OH)2 |
C:
| Pb(OH)2 |
D:
| Mg(OH)2 |
答案:
| PbI2 |
| 已知CaCO3的Ksp= 2.9×10-9,H2CO3的Ka1= 4.2×10-7,Ka2 = 5.6×10-11,将1.0 mol·L-1CaCl2溶液通入CO2气体至饱和,溶液中有无CaCO3沉淀? |
A:
| 刚好饱和,无沉淀 |
B:
| 未达到饱和,无沉淀 |
C:
| 有沉淀 |
D:
| 无法判断 |
答案:
| 未达到饱和,无沉淀 |
| 在已饱和的BaSO4溶液中,加入适量的NaCl,则BaSO4的溶解度 |
A:
| 增大 |
B:
| 不变 |
C:
| 减小 |
D:
| 根据浓度可增大可减小 |
答案:
| 增大 |
| 298.15K时AgCl的溶解度S=1.33×10-5 mol·L-1 ,其Ksp (AgCl)为 |
A:
| 1.77×10-10 |
B:
| 1.77×10-5 |
C:
| 1.77×10-12 |
D:
| 1.77×10-8 |
答案:
| 1.77×10-10 |
| 当AgCl固体在水中的质量不发生变化时,此时溶液中的IP与Ksp的关系是 |
A:
| IP<Ksp |
B:
| IP>Ksp |
C:
| IP=Ksp |
D:
| IP与Ksp同时增大或减小 |
答案:
| IP=Ksp |
| Mg(OH)2的溶度积表达式是 |
A:
| Ksp = [Mg2+][OH–] |
B:
| Ksp = [Mg2+][OH–]2 |
C:
| Ksp = [Mg2+]2[OH–] |
D:
| 无法确定 |
答案:
| Ksp = [Mg2+][OH–]2 |
| 两种难溶电解质,Ksp小的,溶解度一定小 |
A:对
B:错
答案: 错
| IP和Ksp的表达形式类似,但其含义不同。Ksp表示难溶电解质的饱和溶液中离子浓度幂的乘积,仅是IP的一个特例。 |
A:对
B:错
答案: 对
| 由于Ksp (CaSO4)>( KspCaCO3),所以在固体CaSO4中加入Na2CO3溶液,CaSO4将会转化为 CaCO3。 |
A:对
B:错
答案: 对
| 在含有0.01 mol·L-1 Ca2+离子的溶液中,通入足量CO2的气体,将会产生CaCO3沉淀。 |
A:对
B:错
答案: 错
Ksp[Mg(OH)2] = 5.61×10-12,Mg(OH)2在0.01mol·L-1NaOH溶液中[Mg2+]是
A:2.81×10-8mol·L-1
B:1.40×10-8mol·L-1
C:5.61×10-8mol·L-1
D:1.12×10-7mol·L-1
答案: 5.61×10-8mol·L-1
下列关于Ksp的叙述不正确的是
A:相同类型的难溶强电解质,Ksp愈小,溶解度愈小
B:Ksp表示达到沉淀溶解平衡时,难溶强电解质溶液离子浓度幂次方的乘积
C:Ksp只与难溶电解质的本性有关,与其他因素无关
D:1:1型的难溶强电解质,Ksp不一定等于S2
答案: Ksp只与难溶电解质的本性有关,与其他因素无关
已知Ksp[Mg(OH)2] = 5.61×10-12,0.10mol的MgCl2固体溶于1LpH = 10的溶液中,则下列说法正确的是
A:Mg(OH)2溶液刚好饱和,无Mg(OH)2沉淀生成
B:Mg(OH)2溶液还未饱和,无Mg(OH)2沉淀生成
C:有Mg(OH)2沉淀生成
D:无法确定是否有Mg(OH)2沉淀生成
答案: 有Mg(OH)2沉淀生成
已知在CaCO3(Ksp = 3.36×10-9)与CaSO4(Ksp = 4.93×10-5)混合物的饱和溶液中,c(SO42-)= 8.4×10-3mol·L-1,则Ca2+的浓度为
A:5.87×10-5mol·L-1
B:4.00×10-7mol·L-1
C:5.87×10-3mol·L-1
D:4.00×10-5mol·L-1
答案: 5.87×10-3mol·L-1
下列难溶盐的饱和溶液中,Ag+浓度最大的是
A:AgCl(Ksp = 1.77×10-10)
B:Ag2CO3(Ksp = 8.46×10-12)
C:Ag2CrO4(Ksp = 1.12×10-12)
D:AgBr(Ksp = 5.35×10-13)
答案: Ag2CO3(Ksp = 8.46×10-12)
BaSO4在下列哪个溶液中的溶解度最大
A:纯水
B:0.01mol·L-1Na2SO4
C:0.01mol·L-1KNO3
D:0.02mol·L-1BaCl2
答案: 0.01mol·L-1KNO3
在下列哪种溶液中,AgCl的溶解度最小
A:纯水
B:0.1mol·L-1AgNO3溶液
C:0.1mol·L-1NaNO3溶液
D:0.2mol·L-1NaCl溶液
答案: 0.2mol·L-1NaCl溶液
Ag2CrO4(Ksp= 1.12×10-12)在0.1mol·L-1Na2CrO4溶液中的溶解度为
A:8.5×10-6mol·L-1
B:1.7×10-6mol·L-1
C:3.4×10-6mol·L-1
D:1.7×10-8mol·L-1
答案: 1.7×10-6mol·L-1
设Fe2S3饱和溶液的溶解度为S mol·L-1,则Fe2S3的溶度积Ksp为
A:36S5
B:6S2
C:S5
D:108S5
答案: 108S5
设Fe(OH)3饱和溶液的溶解度为S mol·L-1,则Fe(OH)3的溶度积Ksp为
A:36S4
B:S4
C:9S4
D:27S4
答案: 27S4
研究表明,有相当一部分肾结石是由CaC2O4组成的,正常人每天排尿量约为1.4L,其中约含0.1g Ca2+,为了不使尿中形成CaC2O4沉淀,其中C2O42-离子的最高浓度为多少?[CaC2O4的Ksp = 2.3×10-9 , Mr(Ca) = 40)
A:1.1×10-3
B:1.3×10-6
C:2.8×10-5
D:9.12×10-3
答案: 1.3×10-6
向饱和BaSO4溶液中加H2SO4,关于其溶解度S和溶度积Ksp叙述正确的是
A:S增加,Ksp增大
B:S减小,Ksp减小
C:S增大,Ksp不变
D:S减小,Ksp不变
答案: S减小,Ksp不变
Ag2CrO4(Ksp = 1.0×10-12)在0.1mol·L-1AgNO3溶液中的溶解度为
A:2.0×10-10mol·L-1
B:1.0×10-10mol·L-1
C:1.0×10-8mol·L-1
D:1.0×10-9mol·L-1
答案: 1.0×10-10mol·L-1
向AgCl的溶液中加入NaCl,其溶解度降低,溶度积也变小。
A:对
B:错
答案: 错
轨道角动量量子数l=2的某一电子,其磁量子数m
A:只能为+2
B:只能为-+1三者中的某一个数值
C:可以为–2中的任一个数值
D:可以为任何一个数值。
答案: 可以为–2中的任一个数值
基态11Na 原子最外层电子的四个量子数可能是
A:(3,0,0,+1/2)
B:(3,1,0, +1/2)
C:(3,1,-1,+1/2)
D:(3,1,1,+1/2)
答案: (3,0,0,+1/2)
表示原子轨道角度分布的函数是
A:
| Rn, l(r) |
B:
| Yl , m (θ,φ) |
C:
| R2n, l(r) |
D:
| Y2l , m (θ,φ) |
答案:
| Yl , m (θ,φ) |
根据Pauling原子轨道近似能级图,下列各能级中,能量最高的是
A:4s
B:3p
C:2p
D: 2s
答案: 4s
描述原子轨道的量子数组合是
A:n. l
B:n. l. m
C:n. l. ms
D:n. l. m. ms
答案: n. l. m
2p轨道的磁量子数可能有
A:
| 1.2 |
B:
| 0.1.2 |
C:
| 1.2.3 |
D:
| 0.+1.-1 |
答案:
| 0.+1.-1 |
下列符号表示的原子能级,不可能存在的是
A:1s
B:3p
C:3f
D:3d
答案: 3f
多电子原子中,在主量子数为n,角量子数为l的亚层上,原子轨道数为
A:
| 2l+1 |
B:
| n-1 |
C:
| n–l+1 |
D:
| 2l-1 |
答案:
| 2l+1 |
在多电子原子中,原子核对核外某一电子的吸引力由于其余电子对该电子的排斥作用而被减弱,犹如减少了核电荷数,减少后的核电荷数称为有效核电荷数。
A:对
B:错
答案: 对
原子核外每一电子层最多可容纳2n2个电子,所以元素周期系第五周期有50种元素
A:对
B:错
答案: 错
元素的电负性是指原子在分子中吸引成键电子的相对能力。某元素的电负性越大,表明其原子在分子中吸引成键电子的能力越强。
A:对
B:错
答案: 对
对任何原子核外某一电子来说,只有四个量子数完全确定后,其能量才有一定值。
A:对
B:错
答案: 错
电子总是尽可能地先占据能量最低的轨道,当能量最低的轨道已充满后,才依次进入能量较高的轨道。
A:对
B:错
答案: 对
在同一原子中,不可能有四个量子数完全相同的电子存在。每个轨道内最多只能容纳两个自旋方向相反的电子。
A:对
B:错
答案: 对
基态24Cr的价电子组态是
A:4s23d4
B:3d44s2
C:3d54s1
D:4s13d5
答案: 3d54s1
在多电子原子中,决定电子能量的量子数为
A:n
B:n和l
C:n,l和m
D:l
答案: n和l
基态19K原子最外层电子的四个量子数应是
A:4,1,0,+1/2
B:4,1,1,+1/2
C:3,0,0,+1/2
D:4,0,0,+1/2
答案: 4,0,0,+1/2
若将基态氮原子的电子排布式写为1s2 2s2 2px2 2py1,则违背了
A:Hund规则
B:能量守恒原理
C:能量最低原理
D:Pauli不相容原理
答案: Hund规则
用四个量子数表示11号元素基态的最后一个电子的运动状态,正确的为
A:n = 3,l =0,m = 0,s=+1/2
B:n= 3,l =1,m= +1,s=+1/2
C:n = 3,l =1,m =-1,s=+1/2
D:n= 4,l =0,m= 0,s=+1/2
答案: n = 3,l =0,m = 0,s=+1/2
下列各组量子数中,可描述一个p电子的运动状态的是
A:4,3,1,1/2
B:4,0,-1,1/2
C:4,2,0,1/2
D:4,1,0,-1/2
答案: 4,1,0,-1/2
以下电子排布式违反了泡里不相容原理的是
A:1s22s32p1
B:1s22s22px22py1
C:1s22s23s2
D:1s22s22p33s1
答案: 1s22s32p1
下列量子数组合n,l,m,s可用来描述核外电子运动状态的是
A:3,2,0,1
B:3,2,1,1/2
C:3,3,2,1
D:2,2,1,-1/2
答案: 3,2,1,1/2
描述原子轨道或波函数的量子数组合为
A:n,l,m,s
B:n,l
C:l,m
D:n,l,m,
答案: n,l,m,
决定原子轨道在空间伸展方向的量子数是
A:n
B: l
C:m
D:s
答案: m
在多电子原子中具有下列各组量子数的电子,能量最高的是
A:3, 2,+1,+1/2
B:2, 1,+1,-1/2
C: 3, 1, 0,-1/2
D:3, 1,-1,+1/2
答案: 3, 2,+1,+1/2
主量子数为3时,有3s3p3d共3个原子轨道。
A:对
B:错
答案: 错
s电子在球内运动,p电子在双球内运动。
A:对
B:错
答案: 错
电子排布式为1s22s22p23s1的原子虽然不稳定,但可以存在。
A:对
B:错
答案: 对
在氢原子中,电子的能量与角量子数无关。
A:对
B:错
答案: 对
镧系元素和锕系元素的价电子包括f轨道的电子。
A:对
B:错
答案: 对
He原子的1s轨道有两个电子,因此,He原子不能形成双原子分子
A:对
B:错
答案: 对
| 不正确的说法是 |
A:
| α键成键的两原子可沿键轴“自由”旋转; |
B:
| π键也可以单独存在; |
C:
| π键键不牢固不稳定; |
D:
| α键和π键都属于共价键 |
答案:
| π键也可以单独存在; |
π键只能与α键同时存在,在共价双键和共价叁键中只能有一个α键
A:对
B:错
答案: 对
如果某一个原子没有单电子,则不能形成共价键
A:对
B:错
答案: 错
在杂化轨道理论中,正确的是
A:
| 所有参加杂化的轨道中都必须含有一个单电子 |
B:
| 有几个原子轨道参加杂化就能得到几个杂化轨道 |
C:
| 参加杂化的轨道能量必须相等 |
D:
| 所有杂化轨道的能量都一定相等 |
答案:
| 有几个原子轨道参加杂化就能得到几个杂化轨道 |
在下列分子或离子中,中心原子采用等性sp3杂化成键的是
A:PH3
B:H3O+
C:BCl3
D:CCl4
答案: CCl4
C2H4中C原子的杂化方式为
A:sp
B:sp2
C:sp3
D:不等性sp3
答案: sp2
分子中键角最大的是
A:SiH4
B:BF3
C:NH3
D:H2O
答案: BF3
下列液态物质同时存在取向力诱导力色散力和氢键的是:
A:C6H6
B:CCl4
C:O2
D:CH3OH
答案: CH3OH
H2O的沸点比H2S的沸点高得多,主要原因是
A:分子量不同
B:分子的极性不同
C:H2O分子间存在氢键
D:H2O分子间色散力强
答案: H2O分子间存在氢键
下列两两分子间,三种范德华力和氢键都存在的是
A:I2和CCl4
B:I2和H2O
C:HF和H2O
D:CH3Cl和CO
答案: HF和H2O
2p能级上的3个原子轨道的形状和延伸方向完全相同,所以称为简并轨道。
A:对
B:错
答案: 错
水的反常沸点,归因于分子间存在氢键缔合作用
A:对
B:错
答案: 对
均由极性键组成的非极性分子是
A:BF3, CO2, CH4
B:I2, CH4, CO2
C:H2O, CH3Cl, O2
D:H2S, HCl, C6H6
答案: BF3, CO2, CH4
下列分子中,键角最大的是
A:CCl4
B:BF3
C:H2O
D:BeCl2
答案: CCl4
分子之间同时存在取向力诱导力色散力和氢键的是
A:H2S
B:CH3CH3
C:H2O
D:CCl4
答案: H2O
原子轨道沿y轴方向重叠形成π键的是
A:s-s
B:s-px
C:pz– pz
D:py– py
答案: py– py
空间构型为三角锥型的分子是
A:NH4+
B:CH4
C:H2O
D:NH3
答案: NH3
关于杂化轨道理论,下列说法不正确的是
A:成键时,不同原子的外层能量相近的原子轨道重新组合
B:有几个原子轨道参加杂化就形成几个杂化轨道
C:杂化轨道比没杂化的原子轨道成键能力强
D:不同类型的杂化间的夹角不同,形成的分子具有不同的空间构型
答案: 成键时,不同原子的外层能量相近的原子轨道重新组合
甲醇和HI之间存在的分子间作用力不包括
A:取向力
B:氢键
C:诱导力
D:色散力
答案: 氢键
两原子的单电子自旋方向相同时,可形成稳定的共价键。
A:对
B:错
答案: 错
原子轨道沿键轴方向以“头碰头”的方式重叠所形成的共价键为σ键,σ键原子轨道重叠部分镜面对称分布。
A:对
B:错
答案: 错
σ键电子云重叠程度大,比π键稳定。
A:对
B:错
答案: 对
键能的大小与键的极性成正比。
A:对
B:错
答案: 错
直线型分子均属于非极性分子。
A:对
B:错
答案: 错
有几个原子轨道参加杂化,就能形成几个杂化轨道。
A:对
B:错
答案: 对
为使杂化轨道间的排斥能最小,杂化轨道必须取最大夹角分布。
A:对
B:错
答案: 对
氢键具有方向性和饱和性,因此是化学键。
A:对
B:错
答案: 错
乙醇分子跟水分子之间存在范德华力和氢键。
A:对
B:错
答案: 对
碘化氢的沸点比氯化氢的沸点高的原因是碘化氢的色散力强。
A:对
B:错
答案: 对
分子间氢键和分子内氢键都可使物质熔沸点升高。
A:对
B:错
答案: 对
HCl分子是直线形的,故Cl原子采用sp杂化轨道与H原子成键。
A:对
B:错
答案: 错
BCl3分子的极性小于BeCl2分子的极性。
A:对
B:错
答案: 错
具有未成对电子的两个原子相互接近时都可以形成稳定的共价键。
A:对
B:错
答案: 错
sp3杂化时,s轨道和p轨道的主量子数可以相同,也可以是不同。
A:对
B:错
答案: 对
苯与氯仿之间的作用力包括取向力色散力诱导力和氢键。
A:对
B:错
答案: 错
根据分子间作用力,Br2与H2O之间只存在色散力。
A:对
B:错
答案: 错
可以预测,H2S与H2O的键角几乎相同。
A:对
B:错
答案: 对
水的沸点大于硫化氢,归因于水分子间存在氢键。
A:对
B:错
答案: 对
乙炔分子中,碳原子采用sp杂化,形成直线型分子。
A:对
B:错
答案: 对
在乙醇分子中,只有σ键,没有π键。
A:对
B:错
答案: 对
CO分子中存在1个σ键,2个π键,可作为单齿配体使用。
A:对
B:错
答案: 对
邻硝基苯酚的熔点小于对硝基苯酚,主要是由于对硝基苯酚中存在分子间氢键。
A:对
B:错
答案: 对
NH4+离子中N采取sp3杂化方式成键,离子空间构型为正四面体。
A:对
B:错
答案: 对
石墨是层面结构,可作为半导体材料,是由于碳采用sp2杂化引起的。
A:对
B:错
答案: 对
对于He+,描述其原子轨道的能量只需用一个主量子数n即可。
A:对
B:错
答案: 对
在NH4+中的配位键与三个普通共价键等价。
A:对
B:错
答案: 对
成键的两原子之间只有一个σ键,但可以有多π个键。
A:对
B:错
答案: 错
下列分子或离子中,不能作为配体的是
A:
| Cl– |
B:
| NH3 |
C:
| NH4+ |
D:
| H2O |
答案:
| NH4+ |
| 在pH=8.5的[Cu(NH3)4] SO4溶液中,存在平衡:[Cu(NH3)4]2+ Cu2+ + 4NH3。向溶液中分别加入以下试剂,使平衡向右移动的是 |
A:
| NH3 |
B:
| NaNO3 |
C:
| Na2S |
D:
| Na2SO4 |
答案:
| Na2S |
| 配合物H[PtCl3NH3]的配位数为 |
A:3
B:2
C:4
D:6
答案: 4
| 欲使CaCO3在水溶液中的溶解度增大,宜采用的方法是 |
A:
| 加入1.0 mol·L-1 Na2CO3 |
B:
| 加入2.0 mol·L-1 NaOH |
C:
| 加入1.0 mol·L-1 CaCl2 |
D:
| . 加入0.1 mol·L-1 EDTA |
答案:
| . 加入0.1 mol·L-1 EDTA |
| 配合物(NH4)3[SbCl6]的中心离子氧化值和配离子电荷分别是 |
A:
| +-3 |
B:
| +-3 |
C:
| -+3 |
D:
| . -+3 |
答案:
| +-3 |
| 配合物Cu2[SiF6]的正确名称是 |
A:
| 六氟合硅(Ⅳ)化铜 |
B:
| 六氟硅酸铜 |
C:
| 六氟硅酸铜(Ⅰ) |
D:
| 六氟合硅(Ⅳ)酸亚铜 |
答案:
| 六氟合硅(Ⅳ)酸亚铜 |
下列叙述正确的是
A:配合物中的配位键必定是由金属离子接受电子对形成的
B: 配合物都有内界和外界
C: 配位键的强度低于离子键或共价键
D:配合物中,中心原子与配位原子间以配位键结合
答案: 配合物中,中心原子与配位原子间以配位键结合
下列配合物中,只含有多齿配体的是
A:
| . H[AuCl4] |
B:
| [CrCl(NH3)5]Cl |
C:
| . [Co(C2O4)(en)2]Cl |
D:
| . [CoCl2(NO2)(NH3)3] |
答案:
| . [Co(C2O4)(en)2]Cl |
二羟基四水合铝(Ⅲ)配离子的化学式是
A:
| . [Al(OH)2(H2O)4]2+ |
B:
| [Al(OH)2(H2O)4] |
C:
| [Al(H2O)4(OH)2]– |
D:
| . [Al(OH)2(H2O)4]+ |
答案:
| . [Al(OH)2(H2O)4]+ |
配体数等于中心原子的配位数。
A:对
B:错
答案: 错
螯合环越大,螯合物就越稳定。
A:对
B:错
答案: 错
对于不同的配合物,Ks较大者配合物越稳定。
A:对
B:错
答案: 错
螯合物的配体是多齿配体,与中心原子形成环状结构,故螯合物稳定性大。
A:对
B:错
答案: 对
因配离子在水中很稳定,不易解离,所以是一种极弱的酸。
A:对
B:错
答案: 错
在0.1mol·L-1的K[Ag(CN)2]溶液中加入KCN固体,使CN–的浓度为0.1mol·L-1,然后再加入KI固体,使I–的浓度为0.1mol·L-1,观察到的现象是 (Ks([Ag(CN)2]–)= 1.26×1021,Ksp(AgI)= 8.52×10-17)
A:有沉淀生成
B:无沉淀生成
C:有气体放出
D:先有沉淀然后消失
答案: 无沉淀生成
下列配合物命名正确的是
A:K3[Fe(CN)6] 六氰合铁(Ⅲ)化钾
B:[Co(en)(H2O)2(SCN)2]Cl氯化二水·一(乙二胺)·二(硫氰根)合钴(Ⅲ)
C:[Co(ONO)(NH3)5]SO4硫酸一硝基·五氨合钴(Ⅲ)
D: [Zn(NH3)4]SO4硫酸四氨合锌(Ⅱ)
答案: [Zn(NH3)4]SO4硫酸四氨合锌(Ⅱ)
依据次序规则,最优先的是
A:-COOH
B:-CH2Cl
C:-CHO
D:-CN
答案: -CH2Cl
下列碳正离子中最稳定的是
A:
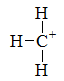
B:
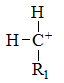
C:
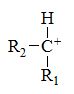
D:
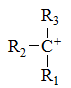
答案:
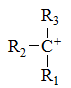
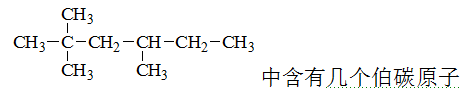
A:3
B:4
C:5
D:6
答案: 5
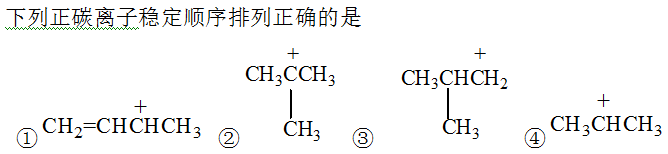
A:①>②>③>④
B:②>④>①>③
C:①>②>④>③
D:②>①>④>③
答案: ①>②>④>③
存在顺反异构的是
A:C2H3Cl
B:C2H4Br2
C:C2H2Cl2
D:C6H4Cl2
答案: C2H2Cl2
稳定性最强的自由基是
A:
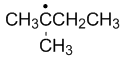
B:
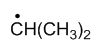
C:
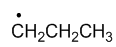
D:
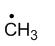
答案:
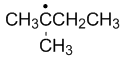
下列属于邻对位定位基的是
A:–NH2
B:-CHO
C: –NO2
D:–COOH
答案: –NH2
苯与溴水反应的机制是
A:自由基取代
B:亲核取代
C:亲电取代
D:亲电加成
答案: 亲电取代
是活化基团的是
A:-NH2
B:-NO2
C:-Cl
D:-COOH
答案: -NH2
定位基 –Cl 属于
A:邻对位定位基
B:间位定位基
C:无法确定
D:其余选项均不是
答案: 邻对位定位基
苯环上的卤代反应属于加成反应。
A:对
B:错
答案: 错
所有含有苯环的有机物都属于芳香烃。
A:对
B:错
答案: 错
常见的稳定的单环烷烃是五元环和六元环。
A:对
B:错
答案: 对
其勺焙扇曙形许捣桐桨乓抒鸿
境拔疚捂鹊吓巾椽举苔撇嘎罢